皆さんはリアルタイムPCR(real-time PCR)について説明できますか?また、実際にリアルタイムPCRを使って遺伝子発現の解析はできますか?
「リアルタイムPCRは講義で学んだが、よく理解できなかった」「リアルタイムPCRを扱ったことはあるが、原理は説明できない」「リアルタイムPCRを卒業研究で使用するので復習したい」「研究以外の場面で、リアルタイムPCRがどのように利用できるか知りたい」
今回はこのような悩みを持つ学生に向けて、リアルタイムPCRの原理と手技、メリットとデメリットをまとめました。また、ウイルスの検出やがん医療での利用についても紹介します。
リアルタイムPCRの目的
リアルタイムPCRの目的は遺伝子発現を定量することです。細胞内で遺伝子が発現する際、ゲノムDNAから転写されたmRNAをもとに、タンパク質が合成されます。リアルタイムPCRでは、転写されたmRNAを定量します。
リアルタイムPCRの原理
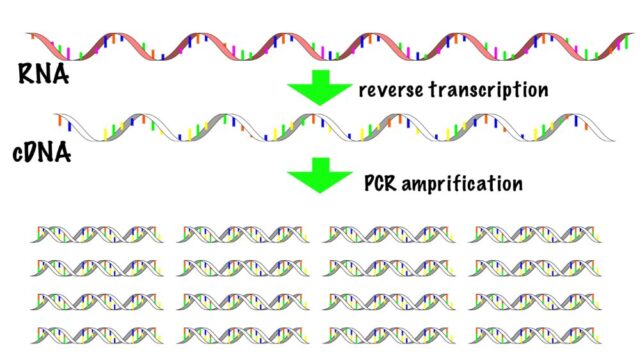
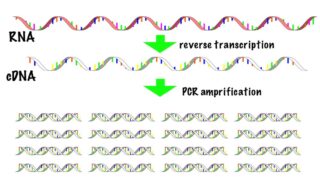
リアルタイムPCRは、組織や細胞から抽出したmRNAより合成したcDNAをPCR(polymerase chain reaction)で増幅させ、その増幅量をリアルタイムにモニタリングします。PCRで増幅されたDNA量が一定量を超えるまでの時間から、元々の発現量を定量します。
リアルタイムPCRでのDNA増幅の検出には、蛍光色素が利用されます。今回は、代表的な検出方法のインターカレーション法とハイブリダイゼーション法を紹介します。
インターカレーション法
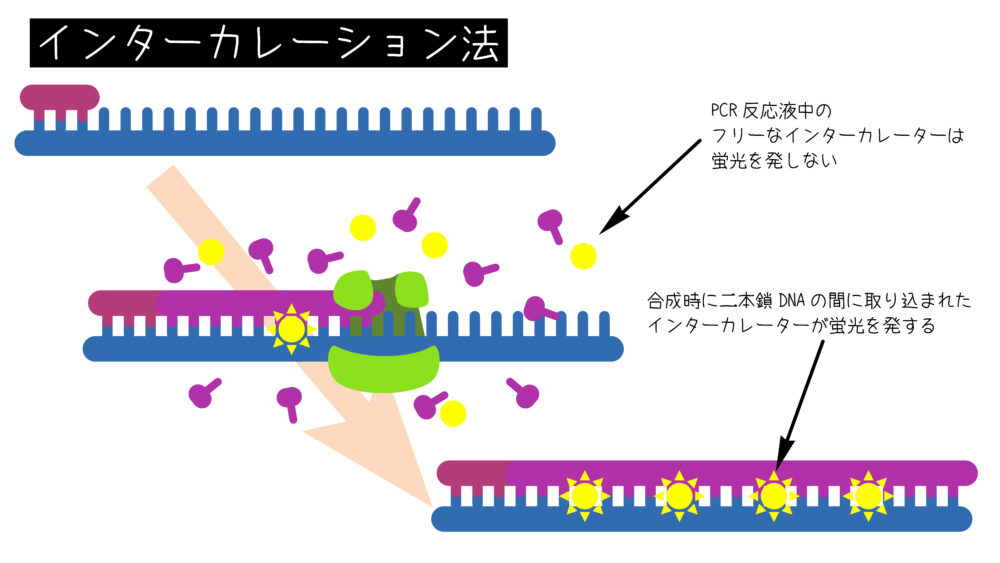

この方法では、二本鎖DNAに結合するインターカレータ-を用いて、DNAの増幅を検出します。代表的なインターカレーターにはSYBR green Iがあります。インターカレーターは二本鎖DNAに特異的に結合し、励起光の照射により蛍光を発します。そのため、PCRにより目的領域が増幅すると、蛍光も増加します。
インターカレーション法のメリット
PCRでインターカレーターを添加するのみでDNAの増幅が検出できます。一方、ハイブリダイゼーション法では検出したい遺伝子ごとに特異的なプローブを準備しなくてはいけません。
インターカレション法のデメリット
インターカレーション法は検出の特異度が低いのがデメリットです。インターカレーション法では二本鎖DNAを非特異的に検出します。そのため、プライマー同士が結合したプライマーダイマーや、プライマーが意図しない領域に結合してしまったことにより合成された二本鎖DNAとも結合します。その結果、本来目的としていない遺伝子まで検出してしまいます。
ハイブリダイゼーション法
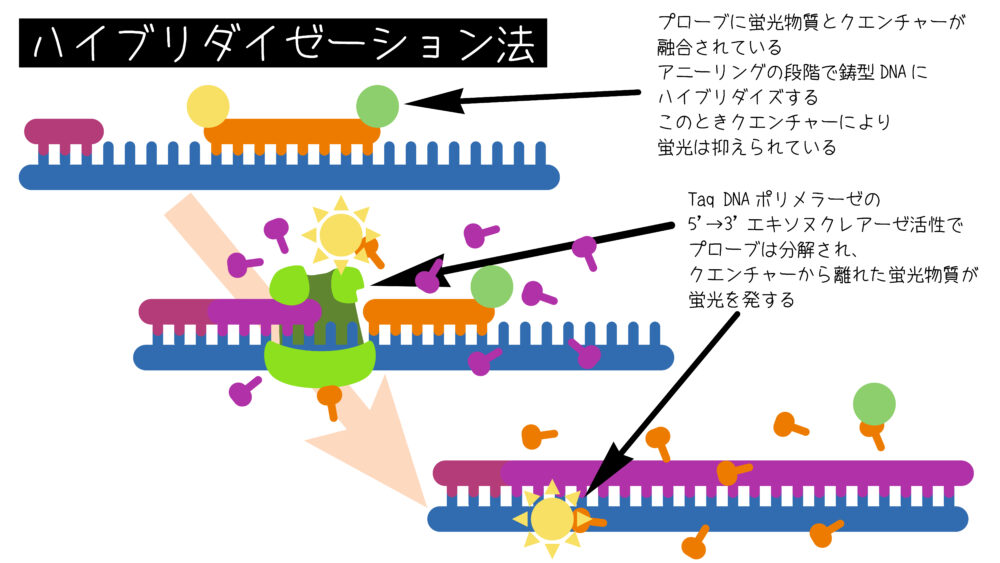

ハイブリダイゼーション法の代表的な方法に、TaqMan®プローブを用いた方法があります。TaqMan®プローブは測定対象のDNAに特異的なプローブです。その構造は5´末端にFAMやVICなどの蛍光色素が、3´末端にNFQなどのクエンチャー(消光物質)が結合しています。初めの状態では蛍光物質は、クエンチャーとの距離が近く、蛍光を発しません。DNAポリメラーゼによってDNAの伸長反応が進むと、TaqMan®プローブが分解され、蛍光色素とクエンチャーが離れます。すると、クエンチャーの影響がなくなり蛍光が生じます。したがって、PCRの反応が進み増幅されたDNAが増加すると、分離された蛍光物質も増え、蛍光強度も増加します。
ハイブリダイゼーション法のメリット
ハイブリダイゼーション法は検出の特異度が高い点がメリットです。TaqMan®プローブはPCRで増幅される領域に特異的に結合し、DNAが合成されたときに蛍光を示します。そのため、プライマー同士やプライマーの意図しない領域に結合して合成された二本鎖DNAを誤って検出しません。つまり、検出の特異度はハイブリダイゼーション法の方がインターカレーション法より高くなります。また、別々の蛍光色素で標識した2種類のTaqMan®プローブを用いることで、同時に2種類の遺伝子発現を検出することも可能です。
ハイブリダイゼーション法のデメリット
ハイブリダイゼーション法のデメリットは、標的遺伝子ごとにプライマーと特異的なプローブの準備が必要な点です。対象の遺伝子用のプライマーとプローブが販売されていない場合、それらを設計、合成する必要があります。そのためには対象となる遺伝子の塩基配列を調べ、プライマーとプローブの塩基配列の設計が必要です。また、設計したプライマーとプローブの合成を外注するための費用もかかります。一方で、インターカレーション法では測定したい遺伝子によらず同じインターカレーターが使用できます。
リアルタイムPCRの手技
ここからはリアルタイムPCRの工程を紹介します。リアルタイムPCRは以下の5つの工程で行います。
- RNAの抽出
- cDNAの準備
- PCRの準備
- PCRによる増幅
- 解析
リアルタイムPCRは、mRNAをcDNAに逆転写してPCRで増幅する、RT-PCRの手法の一つです。上で示した5つの工程のうち、“1. RNAの抽出”と“2. cDNAの準備”はRT-PCRの記事で解説しています。詳細はそちらをご覧ください。



今回の記事では、リアルタイムPCR独自の内容となる“3. PCRの準備”、“4. PCRによる増幅”、“5. 解析”について解説します。
3. PCRの準備
PCRには耐熱性DNAポリメラーゼ、鋳型となるcDNA、cDNAの伸長反応開始に必要なプライマー、DNA合成に用いられる塩基(dNTP)、そして反応が進みcDNAが増幅されたことを検出する蛍光色素を用います。
4. PCRによる増幅
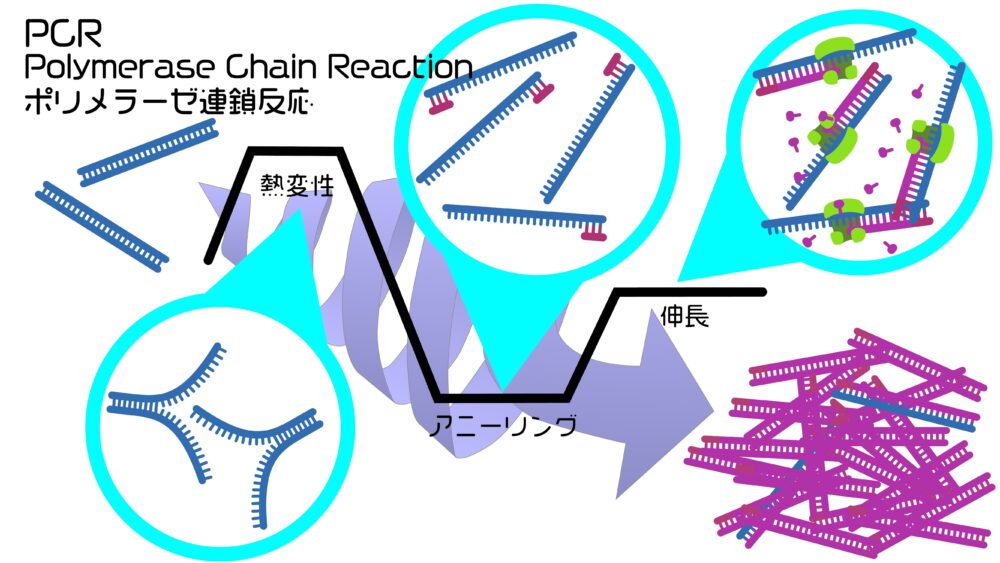

PCRは①熱変性、②アニーリング、③伸長の3つの工程を繰り返すことでDNAの増幅を行います。この3つの工程は温度変化によって切り替えることができます。これらの温度の調節はPCRの測定装置(サーマルサイクラー)で設定することで全自動で反応と蛍光の検出ができます。
リアルタイムPCRではこの3つの工程を約40サイクル繰り返します。この過程でのDNAの増幅を蛍光でリアルタイムにモニタリングします。
5. 解析
最後に、得られた蛍光強度の変化を解析します。解析では、PCR反応で得られた蛍光強度が一定量を超えるまでにかかるサイクル数(Ct値)から元々のcDNAを定量します。定量方法には大きく分けて2種類あります。1つは、コピー数を算出する絶対定量、もう一つは基準となる遺伝子の発現量と比較する相対定量(比較定量)です。
絶対定量
この方法では、濃度が既知のcDNAサンプルを用いて、検量線を作成します。縦軸に初めのcDNA量の対数値を、横軸にCt値をプロットすると右下がりの直線の検量線が引けます。そして、定量したいサンプルのCt値より、増幅前のcDNA量を算出します。
相対定量
この方法では、正確な遺伝子発現を定量するのではなく、基準となる遺伝子との発現量の比を算出、比較します。相対定量には、基準の設定方法として2種類あります。1つ目は刺激前の細胞などコントロール状態のサンプル(キャリブレータ-試料)との遺伝子発現量を比較する方法、もう一つは内部標準を用いる方法です。
内部標準を用いた方法では、同じサンプルから、測定したい遺伝子の発現量と内部標準の発現量との比率を算出し、サンプル間で比較します。内部標準には、多くの細胞で一定の発現量があり、発現量が常に一定のGAPDHやβ-アクチンが用いられます。
リアルタイムPCRのメリットとデメリット
mRNAを定量する方法には、リアルタイムPCR以外にもいくつか方法があります。ここでは、ノーザンブロッティングと比較したときの、リアルタイムPCRのメリットとデメリットについて解説します。
メリットとデメリットを理解して、自分が測定したいmRNAがリアルタイムPCRによる測定が適切か確認することが大切です。
リアルタイムPCRのメリット
定量性が高い
リアルタイムPCRのメリットは定量性の高さです。特に、遺伝子をPCRにより増幅して定量するため、発現量の少ない遺伝子でも定量や比較することができます。一方、ノーザンブロッティングではバンドの濃淡から定量を行います。そのため、微量な遺伝子発現の差が検出できないことがあります。
定量に必要なmRNA量が少ない
リアルタイムPCRではmRNA量が少なくても定量が可能です。PCRで遺伝子を増幅させ定量するためには100 ng程度のRNA(rRAN、mRNA、tRNAを含む)があれば十分です。一方、ノーザンブロッティングでは、5〜10 µgのRNAが必要になり、その分多くの組織や細胞が必要です。
測定時間が短い
リアルタイムPCRはノーザンブロッティングと比較すると測定時間が短い点がメリットです。リアルタイムPCRもノーザンブロッティングも、組織や細胞からRNAを抽出するまでの工程は同じです。しかし、その後の測定時間には大きな差があります。リアルタイムPCRでは、その後の逆転写反応は30分、リアルタイムPCRの反応は1時間で終わる場合もあります。一方ノーザンブロッティングでは、アガロースゲル電気泳動に2〜3時間、ブロットに一晩、ハイブリダイゼーションに一晩かけることもあります。


リアルタイムPCRのデメリット
転写産物のサイズがわからない
リアルタイムPCRでは転写産物サイズの情報は得られません。一方で、ノーザンブロッティングは、アガロースゲル電気泳動でmRNAをサイズごとに分離します。その際にサイズの指標となる分子量ラダーマーカーを同時に流すことで、目的のmRNAのおおよそのサイズがわかります。
人為的な誤差の影響が大きい
リアルタイムPCRでは、コンタミネーション(異物混入)や操作ミスが、定量に大きな影響を与えます。PCRでは、微量の遺伝子でも増幅できます。そのため、他のサンプルがコンタミネーションした場合も増幅、検出されます。また、定量性が高いため、ピペット操作ミスによる誤差も検出される可能性があります。一方ノーザンブロッティングでは、遺伝子の増幅はおこなわれないため、コンタミネーションや操作ミスによる影響は、リアルタイムPCRと比較すると小さいです。
測定にかかるコストが高い
リアルタイムPCRでは専用の測定機器や逆転写酵素、DNAポリメラーゼ、検出に用いるSYBR green IやTaqMan®プローブが必要です。そのため、機器や試薬の費用が、ノーザンブロッティングと比較すると高額になります。



遺伝子の発現定量以外の活用法
リアルタイムPCRの定量以外での活用方法を、2種類紹介します。
- 一塩基多型の解析
- コピー数多型の解析
一塩基多型の解析
一塩基多型(SNP)は、個体間で認められる遺伝子の差異の一種です。遺伝子配列のうち、一つの塩基が別の塩基に置き換わっていることがあります。その結果、タンパク質の合成で質的、量的な変化が生じることで個体差が生まれます。
TaqMan®プローブを用いたリアルタイムPCRによる、SNP検出の原理を解説します。初めに組織や細胞からゲノムDNAを抽出します。検出に用いるTaqMan®プローブはSNPが存在する塩基配列を含み、別の蛍光色素で標識された2種類を用意します。リアルタイムPCRでは、塩基配列が一致した方のTaqMan®プローブのみが反応に使用され、対応する蛍光が検出されます。この結果、抽出した遺伝子がどちらの塩基配列を持っているかがわかります。
コピー数多型の解析
コピー数多型は、同じ遺伝子の数の個体差を指す遺伝子多型の一種です。通常は、1つの細胞には遺伝子が2コピーあります。しかし、コピー数多型が見られる場合は、1つの細胞に1コピーしかない(欠失)または3コピー以上存在(重複)します。コピー数の違いは、先天的な疾患の原因以外に、疾患感受性や薬物感受性に関わると考えられています。
TaqMan®プローブを用いたリアルタイムPCRによるコピー数多型の解析方法を紹介します。TaqMan®プローブは2種類用意します。1つはサンプル(目的とするコピー数多型)を検出できるTaqMan®プローブを、もう1つはリファレンス(コピー数が既知でサンプル間で差が無い遺伝子)を検出できるTaqMan®プローブを準備します。ヒト遺伝子でのリファレンスには、主にRNase Pが用いられます。この2種類のTaqMan®プローブを用いてゲノムDNAを鋳型にリアルタイムPCRを行います。その結果、リファレンスに対してサンプルの遺伝子発現が同じであればコピー数多型なし、サンプルの遺伝子発現が少なければ欠失、サンプルの遺伝子発現が多ければ重複があることがわかります。
リアルタイムPCRの医療での利用
ここまで、リアルタイムPCRの原理や、研究現場での活用方法について紹介しました。次は、リアルタイムPCRの技術が研究以外でどのように利用されているか、医療分野での実用を2つ紹介します。
- ウイルスの検出
- がん細胞の変異の特定と治療薬の決定
ウイルスの検出
ウイルス感染を調べる目的でリアルタイムPCRが利用されます。検出できるウイルスには、COVID-19、B型肝炎、C型肝炎などがあります。ウイルスは、DNAまたはRNAの遺伝子情報とそれを包むタンパク質で構成されています。また、ウイルス単体では増えることが出来ないため、培養、増殖させて観察することが出来ません。
リアルタイムPCRでは、直接DNAまたはRNAを検出、定量することが可能なため、感染の診断に用いられます。また、リアルタイムPCRは検出に必要な遺伝子量が少なく、ウイルス量の少ない感染初期でも検出することができます。さらに、検査に必要なサンプルも少なくて済むため、鼻やのどをぬぐって得られた液や痰、わずか2mlの血液で検査することができます。
がん細胞の変異の特定と治療薬の決定
がん細胞の遺伝子変異を治療開始前に調べ、治療に活かす目的でリアルタイムPCRが利用されています。
がんは、正常な細胞に遺伝子変異が生じ、発生します。そして、その遺伝子変異によって、特定の抗がん剤が有効になることや、逆に特定の抗がん剤が無効となることがわかっています。実際、肺がんや大腸がんでは、この遺伝子変異の有無や種類により使用できる治療薬が決まります。
現在は、リアルタイムPCRでがん細胞の遺伝子変異を調べる検査に保険適応があります。このリアルタイムPCRによる遺伝子変異の検査により最適ながん治療ができるようになりました。
まとめ
今回の記事ではリアルタイムPCRについて紹介しました。
組織や細胞の遺伝子発現を検出、定量する
mRNAより合成したcDNAをPCRで増幅させ、その増幅量をリアルタイムにモニタリングする。増幅されたDNA量が一定量を超えるまでの時間から元々の遺伝子量を定量する。
ノーザンブロッティングと比較したときのメリットとデメリット
- RNAの抽出
- cDNAの準備
- PCRの準備
- PCRによる増幅
- 解析
- 一遺伝子多型の解析
- コピー数多型の解析
- ウイルスの検出
- がん細胞の変異の特定と治療薬の決定
mRNAを測定する方法はリアルタイムPCR以外にもあります。他の方法については、下記記事にて紹介しています。