※本ページにはプロモーションが含まれます
そういった疑問に、生命科学系の大学院博士課程を経て、現在も大学の研究現場で務めている私が解説します。
この記事では、次のことを解説しています。
- SDS-PAGEはタンパク質を分子量で分離する手法
- タンパク質の立体構造をほどき負電荷を付加した状態でポリアクリルアミドゲル電気泳動することで、タンパク質を分子量により分離できる
- ゲルの濃度によって、分離できる分子量の範囲が変わる
- SDS-PAGE後は、CBB染色、銀染色、ウェスタンブロッティングといった手法でタンパク質を検出する
- SDS-PAGEでよくある失敗要因
タンパク質を解析するためには避けては通れない手法であるSDS-PAGE。理解しておかなければならない内容満載で、解説していきます。
SDS-PAGEでタンパク質を分子量ごとに分離する
SDS-PAGE(SDS-ポリアクリルアミドゲル電気泳動)とは、電気泳動によってタンパク質を分子量ごとに分離する技術です。タンパク質の分子量は、数kDaから数百kDaの範囲で決定することができ、生化学、分子生物学、細胞生物学などの分野でよく利用されている技術です。
主に、
- タンパク質の分子量の決定
- サンプル間で量に違いがあるタンパク質が存在するかの検出
- 精製したタンパク質サンプルの純度を確かめる
といった目的で利用されます。
SDS-PAGEの原理
分子量ごとにタンパク質を分離するためのサンプル処理
タンパク質溶液をそのまま電気泳動しても、分子量ごとに分離することはできません。そこで、次の3つの処理によって、分子量ごとに分離可能なサンプルにします。
- SDS
- 還元剤
- 加熱
SDS
タンパク質を含む溶液に、強力な陰イオン性界面活性剤であるSDSを加えることで、タンパク質に負電荷を与えます。SDS分子は強い負電荷をもち、ポリペプチド鎖と複合体を作るためです。
分子量の大きなタンパク質には多くのSDS分子が結合し、負電荷が強くなります。一方で、分子量の小さなタンパク質にはSDS分子があまり多く結合することができないため、相対的に負電荷は弱くなります。
SDS-タンパク質複合体を形成させることで、タンパク質の分子量≒負電荷の大きさという状態にすることができます。
還元剤
還元剤処理することで、タンパク質のS-S結合(ジスルフィド結合)を切断します。
タンパク質の立体構造は、水素結合とS-S結合で保たれています。水素結合はSDSにより壊すことができますが、S-S結合は還元剤を使用しなければ壊すことができません。
また、S-S結合は1つのポリペプチド鎖内だけでなく、複数のポリペプチド鎖間を結合させることもあります。その例が、抗体タンパク質、免疫グロブリンです。免疫グロブリンは、2本ずつの軽鎖と重鎖の、計4本のポリペプチド鎖が集まったタンパク質です。これらのポリペプチド鎖がS-S結合で結合し、”Y”字型のタンパク質となっています。
SDS-PAGEサンプルの還元処理には、β-mercaptoethanolやDTT(ジチオトレイトール)が使用されます。還元剤を加える量や時間が結果に影響を与えるため、場合によっては条件の検討が必要になる場合があります。
加熱
サンプルを高温で加熱することで、タンパク質の立体構造を完全にほどくことができます。さらに、SDSがタンパク質に結合しやすくなり、還元剤によるS-S結合の切断効率が上がります。
加熱により、もともとのタンパク質の立体構造がポリアクリルアミドゲルで泳動したときの移動度に影響を与えることがなくなり、タンパク質の負電荷の大きさ≒分子量によってタンパク質を分離することができるようになります。
ただしタンパク質によっては、高温で加熱すると分解されてしまうこともあります。タンパク質の性質によっては、室温でオーバーナイト、37℃で3時間、60℃で15分、といった条件で変性させる場合もあります。
ポリアクリルアミドゲルで分離する
調製したSDS-タンパク質溶液を、ポリアクリルアミドゲルによって分離します。ゲル上部のウェル(穴)にサンプルをのせて電圧をかけると、負電荷をもつタンパク質は陽極方向に移動していきます。
ポリアクリルアミドゲルは網目構造をしています。そのゲル内では、大きなタンパク質はゲル内を移動しづらく、逆に小さなタンパク質はゲル内を移動しやすいです。したがって、タンパク質を分子量ごとに分離することができるのです。
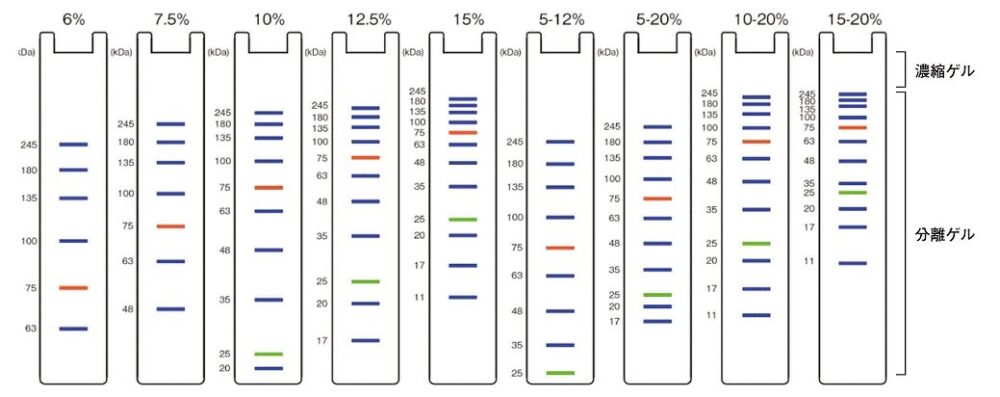
また、濃度が低い(やわらかい)ポリアクリルアミドゲルは、目の大きな網目構造をもち、分子量の大きなタンパク質の分離能が高くなります。一方で濃度が高い(かたい)ポリアクリルアミドゲルは、目の細かい網目構造をもち、分子量の小さなタンパク質の分離能が高くなります。
濃縮ゲルでタンパク質が濃縮される原理
一般的に行われているSDS-PAGEで使われているポリアクリルアミドゲルは、pH6.8の濃縮ゲルとpH8.8の分離ゲルで構成されています。
pH6.8の濃縮ゲル中では、泳動バッファー中のグリシンが双性イオン化し、移動度が小さくなります。次いで移動度が小さいのがタンパク質、移動度が大きいのが塩素イオンです。その結果、濃縮ゲル中でのタンパク質サンプルは、塩素イオンとグリシンに挟まれた状態になります。
移動度の違いにより、塩素イオンとタンパク質の境界部分、タンパク質とグリシンの境界部分では、一時的にイオンが不足する状態になります。イオンが不足することで抵抗が大きくなり、境界後ろ側のゾーンの移動速度が早くなります。結果、タンパク質サンプルが濃縮されるのです。
pH8.8の分離ゲルに到達すると、グリシンが陰イオン化します。その結果、グリシンの移動度がタンパク質よりも大きくなり、ゲルの網目構造により分子量の違いでタンパク質が分離されるようになります。
濃縮ゲルでタンパク質が濃縮されることで、ゲル上部にのせたサンプル量が多くても、電気泳動後にタンパク質がシャープなバンドとして検出されるのです。
SDS-PAGEの手順
SDS-PAGEは、以下の手順で行います。
- サンプルの準備
- サンプルの加熱
- ゲルの作成
- サンプルの泳動
- タンパク質の検出
サンプルの準備
分析するタンパク質を含むサンプルを準備します。サンプルには、SDSサンプルバッファーおよび還元剤(β-mercaptoethanolやDTT)を加えます。
サンプルの加熱
サンプルを加熱し、タンパク質の立体構造を完全にほどきます。この手順により、タンパク質を分子量ごとに分離することができるようになります。
ゲルの作成
SDS-PAGE用のゲルを作成します。分離ゲルの濃度は、分離したいタンパク質の分子量で決定します。
| 6% | 7.5% | 10% | 12.5% | 15% | |
|---|---|---|---|---|---|
| 水 | 5.5ml | 5.0ml | 4.2ml | 3.3ml | 2.5ml |
| 30%アクリルアミド | 2.0ml | 2.5ml | 3.3ml | 4.2ml | 5.0ml |
| 1.5M Tris-HCl(pH8.8) | 2.5ml | 2.5ml | 2.5ml | 2.5ml | 2.5ml |
| 10% SDS | 100µl | 100µl | 100µl | 100µl | 100µl |
| 10% APS | 50µl | 50µl | 50µl | 50µl | 50µl |
| TEMED | 10µl | 10µl | 10µl | 10µl | 10µl |
| 水 | 3.00ml |
| 30%アクリルアミド | 0.67ml |
| 0.5M Tris-HCl(pH6.8) | 1.25ml |
| 10% SDS | 50µl |
| 10% APS | 25µl |
| TEMED | 5µl |
サンプルの泳動
サンプルをゲルに流し込み、電気泳動を行います。
ゲル1枚あたり30mA、約1時間を目安に、泳動先端(BPB)がゲル下端に到達するくらいまで泳動します。ただし使用している試薬の組成が異なる場合、泳動にかかる時間が変わる場合があります。
場合によっては、ゲルの抵抗で発生する熱で泳動が乱れることがあります。その場合は電流の設定値を小さくし、泳動時間を長くします。電流を半分にすると、泳動時間はだいたい倍になります。
タンパク質の検出
泳動したタンパク質を検出することで、タンパク質バンドを確認します。検出には次のような方法があります。
- CBB染色
- 銀染色
- ウェスタンブロッティング
CBB染色
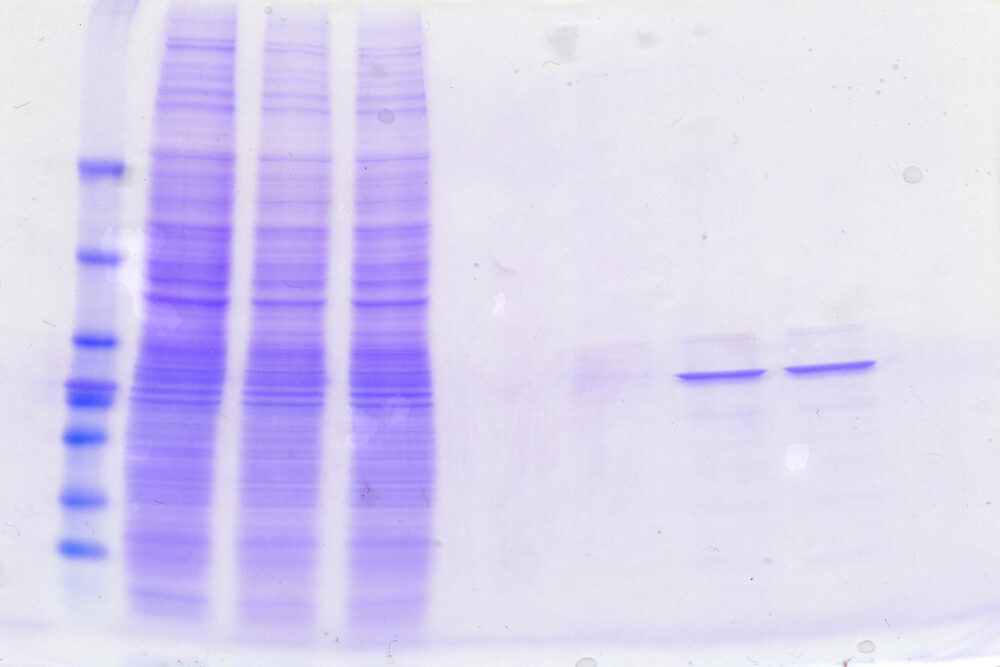
泳動が終了したゲルのまま、CBB(クマシーブリリアントブルー)であらゆるタンパク質を染色する方法です。酸性バッファー条件下でCBBは、タンパク質の塩基性/疎水性残基に結合します。染色されたタンパク質は、青いバンドとして検出することができます。
ただし、感度はそこまで高くはなく、バンド1つあたり25ng程度ないと検出することができません。
上画像は、3種の細胞抽出液(左側)とそこから特定のタンパク質を精製したサンプル(右側)を、電気泳動してCBB染色したものです。精製前の細胞抽出液では多種のタンパク質が確認できましたが、精製後のサンプルではごくわずかな種類のタンパク質しか検出されなかったことが見て取れます。
銀染色
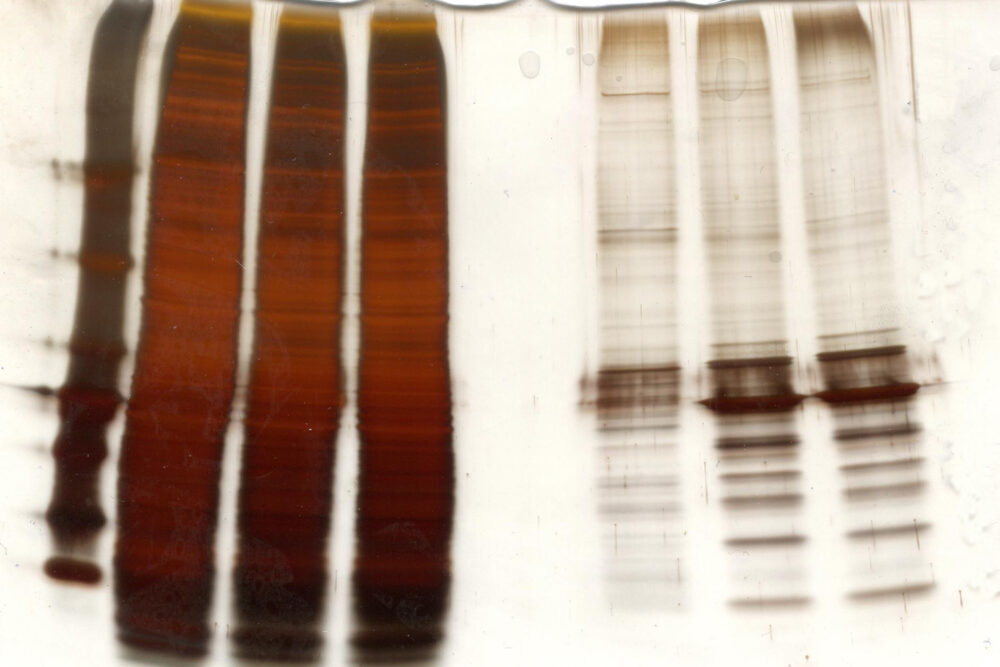
泳動が終了したゲルのまま、銀を用いてあらゆるタンパク質を染色する方法です。銀イオンは、タンパク質のカルボキシル基(COOH)やチオール基(SH)などの特定の官能基と結合します。その後銀イオンを還元することで、金属銀が析出し、タンパク質をバンドとして検出します。
感度はCBB染色の10倍以上で、数ngグラムのタンパク質でも検出することができます。上写真は、CBB染色の写真のゲルを銀染色したものです。CBB染色では検出できていなかったバンドが、感度が高い銀染色では検出できていることがわかります。
ただし、CBB染色と比べると操作が煩雑です。
ウェスタンブロッティング

泳動後のゲルからタンパク質を膜に転写し、抗原抗体反応を用いて特定のタンパク質を検出する手法です。特定のタンパク質を検出する手法はいくつかある中で、ウェスタンブロッティングが最も広く使われています。
検出感度や特異性は、使用する抗体や抗体の検出法に依存します。高感度なものになると、pg(ピコグラム、ngの1/1,000)以下のタンパク質のバンドを検出することもできます。

Native PAGEもポリアクリルアミドゲルでタンパク質を分離することができる
同じポリアクリルアミドゲルを使うタンパク質の電気泳動法に、Native PAGEがあります。
Native PAGEは、タンパク質の立体構造・サブユニット構造を維持したまま分離を行います。ゲル中での移動度は、分子量だけでなく、タンパク質自身がもつ電荷やとっている構造にも影響されます。
SDS-PAGEとは違い、Native PAGEのサンプルにはSDSや還元剤を加えず、加熱も行いません。
分子量の測定はできないものの、泳動後も酵素活性が保たれることが多く、泳動後のゲルを特定の基質により染色することで、その基質に対する酵素を検出することも可能です。
SDS-PAGEとNative PAGEの使い分け
SDS-PAGEは、タンパク質の分子量を決定するために用いられます。一方で、Native PAGEはタンパク質の高次構造や相互作用を調べる場合に用いられます。
これらの使い分けは、サンプルを変性させるかどうかという違いによるものです。
SDS-PAGEのよくある失敗要因
SDS-PAGEは、タンパク質を分子量ごとに分離するために用いられる技術ですが、いくつかの失敗の要因があります。下記にSDS-PAGEでよくある失敗例をいくつか挙げます。
- タンパク質が十分に溶解されていない
- タンパク質が変性しきっていない
- ゲルの不良
- 不適切な電気泳動条件
- 不適切な検出条件
タンパク質が十分に溶解されていない
タンパク質を溶解する溶液が不適切な場合、ゲルで泳動できるタンパク質量が少なくなり、検出感度以下となってしまうことがあります。
例えば、細胞膜や細胞小器官の膜上にあるタンパク質は、疎水性が高い場合が多いです。そのため細胞からタンパク質を抽出する際に、適当な界面活性剤を含む溶液を使用しなければ、十分に溶解させることができません。
タンパク質が変性しきっていない
SDS-PAGEではタンパク質をSDS、還元剤、加熱によって変性させることで、分子量ごとに分離することができます。
SDSでタンパク質が分子量に応じた負電荷を付加できなかった場合、還元剤を用いたS-S結合の切断が行われなかった場合、加熱によりタンパク質の立体構造を完全にほどくことができなかった場合、電気泳動による移動度が分子量以外の要素によっても決まることになります。
ゲルの不良
使用するゲルが、検出したい目的のタンパク質に適していない場合、分子量による分離が行われないことがあります。
例えば、検出したいタンパク質が100kDaをこえるようなタンパク質の場合、使用するポリアクリルアミドゲルは、濃度が低く、やわらかいものが適しています。濃度が低いゲルは高分子量の範囲での分解能が高くなるためです。
逆に、濃度が高くかたいゲルを使用すると、低分子量の範囲での分解能が高いため、100kDaをこえるようなタンパク質は、似た分子量のタンパク質から分離することが難しくなります。
不適切な電気泳動条件
電気泳動条件が不適切だと、タンパク質をきれいに分離させることができなくなります。
例えば、かかる電圧が高くなると、ゲルの抵抗値が大きくなり、発生するジュール熱の影響で泳動が乱れることがあります。逆に電圧が低すぎる場合、電気泳動による移動速度よりも、ゲル中を拡散しようとする速度の方が上回り、検出されるタンパク質のバンドがはっきりとしなくなります。
不適切な検出方法・条件
検出したいタンパク質に合わせた検出方法や条件を選択しなければ、バンドが検出できない、バンドどうしがくっついてしまい判別がつかない、といった問題が起こります。
例えば、ごく微量な特定のタンパク質しかサンプル中に含まれていないのに、CBB染色で検出を試みようとしても、検出感度が低いため検出できないかもしれません。
逆に、細胞からのタンパク質抽出液のような、あらゆるタンパク質が含まれていて、かつタンパク質量が多いサンプルを泳動した後、銀染色を行うと、サンプルを泳動したレーン全体が染色されるような結果となることがあります。
タンパク質分離法としてのSDS-PAGEの今後
SDS-PAGEはタンパク質の分離法として、現在広く使用されています。しかし、最近では、新しいタンパク質分離技術が発展しており、SDS-PAGEに代わる可能性があると言われています。
- 二次元電気泳動
- LC-MS
- キャピラリー電気泳動
SDS-PAGEは、簡便でありながらも高い分解能を有したタンパク質分離法であり、今後も重要なタンパク質分離技術の1つであり続けると考えられます。しかし、これらの新しいタンパク質分離技術が発展することで、SDS-PAGEの使用頻度は減少する未来もありえます。
二次元電気泳動
SDS-PAGEは、タンパク質の分子量ごとに分離する方法であり、質的情報や相互作用の情報を得ることができません。しかし、別の電気泳動法と組み合わせた二次元電気泳動を行うことで、分子量以外の情報を得ることができるようになります。
例えば、1次元目はタンパク質の等電点によって分離する等電点電気泳動を行い、2次元目は分子量によって分離するSDS-PAGEを行うことで、より多種類のタンパク質を分離することができます。
また、1次元目は立体構造や相互作用を保った状態で分離するNative PAGEを行い、2次元目はSDS-PAGEを行うことで、タンパク質複合体内のタンパク質を分離することができます。
LC-MS
LC-MSとは液体クロマトグラフィー質量分析法(Liquid Chromatography-Mass spectrometry)の略称で、液体クロマトグラフで分離したサンプルを、質量分析法で質量電荷比ごとに分離して検出する手法です。
液体クロマトグラフの種類によって、どのようなタンパク質を高効率で分離できるかが変わります。
また、質量分析法では、最終的にアミノ酸配列レベルでの決定も可能です。
したがって、わずかな違いしかない似たタンパク質でも、高い精度で分離し検出することができるのです。
キャピラリー電気泳動
キャピラリー電気泳動は、SDS-PAGEと同様にタンパク質の分子量を決定することができます。しかしキャピラリー電気泳動は、少ないサンプル量で測定することができたり、高い分解能をもつというメリットがあります。さらに、SDS-PAGEを用いた解析よりも、所要時間が短い点も特徴です。
実際、サンガー法による塩基配列の決定には、以前はポリアクリルアミドゲル電気泳動で2日ほどの時間がかかっていました。しかし現在は、キャピラリー電気泳動を用いて数時間で解析が完了するようになっています。
まとめ
この記事では、タンパク質研究では欠かせない手法である、SDS-PAGEについて解説しました。
- SDS-PAGEはタンパク質を分子量で分離する手法
- タンパク質の立体構造をほどき負電荷を付加した状態でポリアクリルアミドゲル電気泳動することで、タンパク質を分子量により分離できる
- ゲルの濃度によって、分離できる分子量の範囲が変わる
- SDS-PAGE後は、CBB染色、銀染色、ウェスタンブロッティングといった手法でタンパク質を検出する
- SDS-PAGEでよくある失敗要因
タンパク質を具体的に定量・定性する手法については、こちらの記事にてまとめています。