そう思っているそこの学生さん、そんなあなたのために、生命科学系の大学院博士課程を経て、現在も大学の研究現場で務めている私が、核酸の電気泳動について解説します。
- 核酸を電気泳動で分離して検出する原理
- 核酸を電気泳動して検出するまでの5ステップ
- アガロースゲルの濃度で分けられる分子量範囲が決まる
- バンド強度で大まかに定量できる
- RNAの品質をチェックできる
- アガロースゲルから核酸を取り出せる
- 電気泳動でよくある失敗の原因3選
実際に電気泳動をやったことが無くても、この記事を読むだけで電気泳動のポイントを押さえることができます。やったことがある人は、結果の見方や失敗しやすい原因を学ぶことができます。
核酸(DNA・RNA)を電気泳動で分離して検出する原理
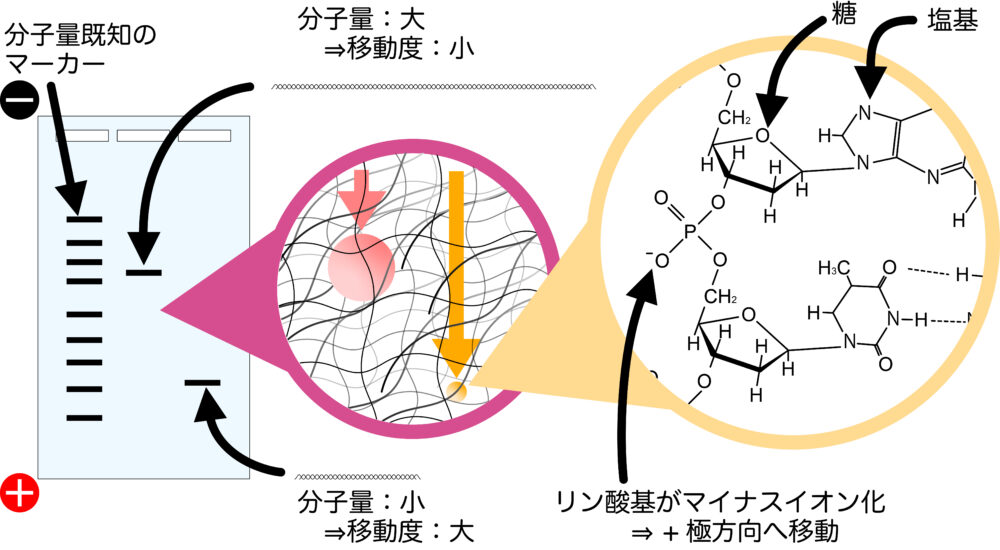
水溶液中の核酸はマイナスに荷電しています。なぜなら、拡散を構成する糖・リン酸基・塩基のうち、リン酸基が水溶液中でマイナスイオンになるためです。
そのため核酸は、電圧をかけるとプラス側に引き寄せられていきます。
このとき、核酸をゲルの中に入れると、分子量ごとに分離することができます。ゲルは網目状の構造をしており、分子量が小さいと網目のすき間を通り抜けやすく、分子量が大きいと網目に引っかかりやすいためです。
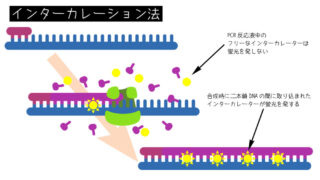
ゲル中の核酸は、染色剤で染色することで検出します。DNAに対しては、臭化エチジウムという蛍光を発する染色剤がよく使われます。
泳動したDNAの分子量は、分子量が既知のDNAマーカーとバンドの位置を比較することで、おおよそ同定します。また、バンドのシグナル強度を比較することで、バンド中の核酸量を定量することができます。
核酸の電気泳動で使用するゲルは、アガロースゲルとアクリルアミドゲルの2種類があります。以降この記事では、アガロースゲルを使った電気泳動を解説していきます。
核酸を電気泳動で検出・定量するステップ
核酸の電気泳動法には、核酸を分離させてから染色する方法と、分離する前に核酸やゲルを染色しておく方法があります。
ここでは、DNAを分離させてから染色する方法を説明します。
- ゲルを作る
- 核酸サンプルをウェルに入れる
- 泳動する
- 臭化エチジウムで染色する
- 紫外線を当てて検出する
ゲルを作る

まずはアガロースゲルを作ります。アガロースとは、寒天の主成分である多糖です。つまり、アガロースゲルは「ほぼ寒天」なのです。
アガロースゲルを作るときは、アガロース粉末とバッファー(TAEやTBEがよく使われる)をフラスコに入れ、電子レンジで加熱します。アガロースが溶けたら、コームと呼ばれるくし形のパーツを取り付けた型に流し込みます。この状態で冷やし固めると、サンプルを泳動することができるゲルが出来上がります。
核酸サンプルを入れる
ゲルが固まったら、電気泳動槽にバッファー(TAEやTBEがよく使われる)とゲルを入れ、ウェルの中にサンプルを入れていきます。サンプルには、ローディングバッファーを混ぜておきます。ローディングバッファーには、次の3つの役割があります。
- 比重を大きくする:グリセロールやフィコールを含み、サンプルの比重を水より大きくすることで、サンプルをウェルの底に沈ませることができます。
- ウェルに入ったことが確認できる:ローディングバッファーには色素が含まれており、ウェルに入っていく様子が確認できます。
- 泳動の進み具合を確認できる:色素も電気泳動によってゲル中を移動するので、泳動の進み具合を確認することができます。
※このとき、核酸は染色されていないため目視では確認できません。
分子量マーカーも別のウェルに入れていきます。分子量マーカーには、分子量がすでに分かっているDNAがいくつか入っていて、最終的にこのマーカーと比べることでサンプルDNAの分子量を判断します。
泳動する
ウェルにサンプルを入れたら、上流(ウェル側)にマイナス、下流(ウェルと反対側)にプラスの電極を挿して、電圧をかけます。
臭化エチジウムで染色する
ゲルを電気泳動槽から取り出し、水またはゲル緩衝液で希釈した0.5µg/mlの臭化エチジウム液に、ゲルを浸します。一定時間浸したのち、ゲルを取り出して蒸留水ですすぎ、余分な臭化エチジウムを洗い落とします。
紫外線を当てて検出する
DNA2本鎖に取り込まれた臭化エチジウムは、紫外線(230nm)を当てると蛍光を発します。そのため、ゲル中のDNAが光って見えます。このバンドの光る強さは、そこにある臭化エチジウムの量、つまりDNA量に比例します。そのため、バンドの蛍光強度でどのくらいのDNAがそこにあるかわかります。
泳動後のゲルを染色する方法で解説しましたが、DNAサンプルに臭化エチジウムを加えたり、加熱して溶かしたアガロース溶液に臭化エチジウムを加える方法もあります。
RNAサンプルでも、作業工程は同じです。ただし、臭化エチジウムはRNAへの結合効率が低い(DNAの20分の1ほど)ため、1本鎖核酸に強く結合する染色剤を使うことがあります。
アガロースゲルの濃度で分けられる分子量範囲が決まる
アガロースゲルの濃度を変えると、分離できる分子量の範囲が変わってきます。
- 濃度が高いゲル:網目が細かく、小さめの分子量の核酸を分離しやすい
- 濃度が低いゲル:網目が大きく、大きめの分子量の核酸を分離しやすい
| ゲル濃度(%) | 分離できる範囲(bp) |
|---|---|
| 0.5 | 2,000〜50,000 |
| 0.6 | 1,000〜20,000 |
| 0.7 | 800〜12,000 |
| 0.8 | 800〜10,000 |
| 0.9 | 600〜10,000 |
| 1.0 | 400〜8,000 |
| 1.2 | 300〜7,000 |
| 1.5 | 200〜3,000 |
| 2.0 | 100〜2,000 |
| 3.0 | 25〜1,000 |
| 4.0 | 10〜500 |
| 5.0 | 10〜300 |
バンド強度で大まかに定量できる
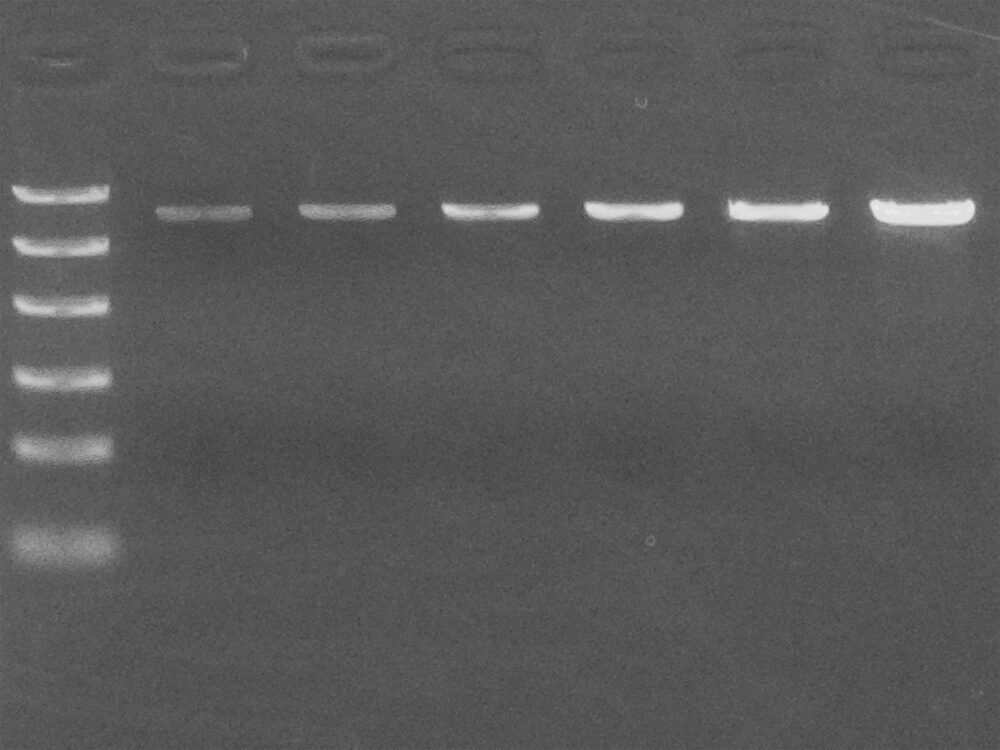
核酸の電気泳動法では、臭化エチジウム(またはその他の蛍光標識)が光ることで核酸を検出できます。このとき、量がすでにわかっているサンプルや分子量マーカーと比較することで、サンプルの定量ができます。
RNAの品質をチェックできる
RNAはとても不安定で分解されやすいです。人は、手の表面、唾液、フケや汗などいたるところにRNA分解酵素を持っています。そのため、マスクや手袋などでそれらがサンプルに混入してしまわないように気を付けないと、すぐにRNAが分解されてしまいます。
真核生物の細胞から抽出したトータルRNAを電気泳動で解析する場合、RNAが分解を受けていないか確認する方法があります。それがリボソームRNA(rRNA)を定量する方法です。
リボソームには、28Sと18SのrRNAが約1:1の量で入っています。そして大きさの違いから、電気泳動を行うとバンドが約2:1の割合に見えます(下図Sample 1)。しかしこれらのrRNAは、RNA分解酵素で分解を受けると断片化されてしまいます。それにより、RNAが分解されている場合には、電気泳動の結果、以下の2つの現象がみられることがあります。
- 28Sと18Sの比が2未満になっている(下図Sample 2)
- より小さい分子量の部分にスメアがみられる(下図Sample 3・4)
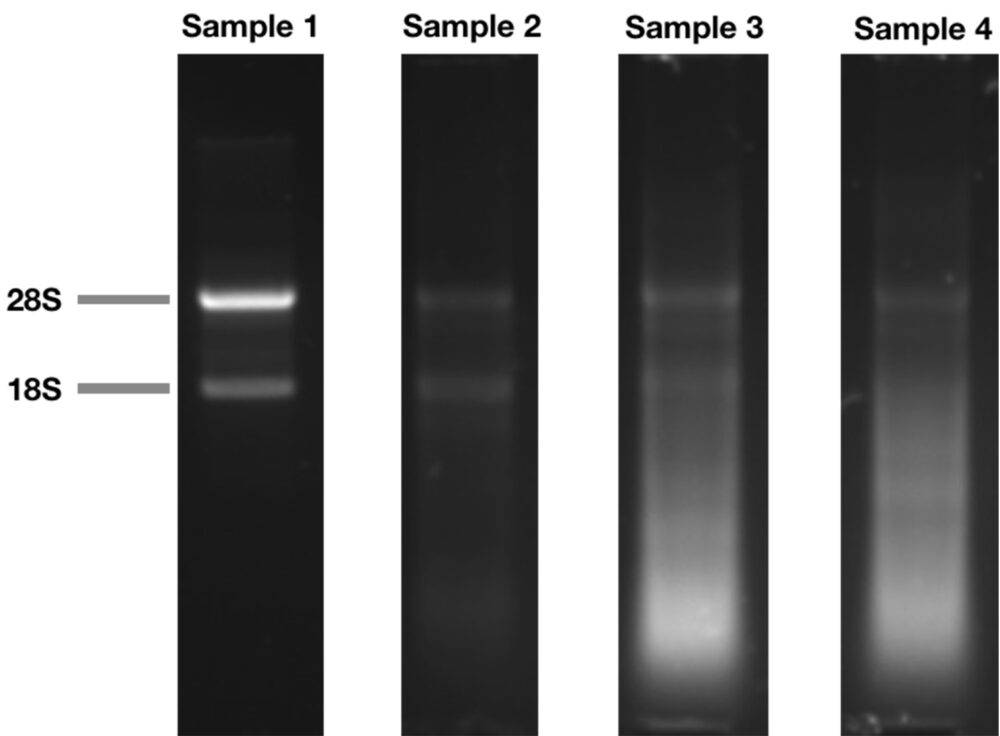
※18Sや28SのSは、遠心機で遠心したときに沈降していく速度を示す係数です。比重が大きいものや球形に近い形状のものが、沈降係数はおおきくなります。
ゲルから核酸サンプルを取り出せる
電気泳動によって分離した核酸サンプルは、ゲルから取り出すことができます。
電気泳動してサンプル中の核酸を分離し、目的分子量のバンドを切り取ります。切り出したゲルを溶解し、エタノール沈殿やカラム精製といった手法を用いることで、目的の分子量の核酸のみを精製することができます。
このように精製した核酸は、遺伝子組換え実験などによく使われます。
アガロースゲル電気泳動でよくある失敗の原因3選
「電気泳動をやってみたけれど、綺麗なバンドにならなかった!」という失敗は、実験をしていく中で誰しもが通る道です。電気泳動で失敗してしまう原因はたくさんあるのですが、その中でもありがちな原因を3つ解説します。
- サンプルの分解
- ゲルの崩れ
- サンプル量が多い・少ない
サンプルの分解
”RNAの品質をチェックできる”の項でも出てきたRNAはもちろん、DNAも、サンプルに分解酵素が混入することで、分解されることがあります。
電気泳動の結果を見て、想定される分子量よりも低い位置にスメアがみられた場合は、分解されている可能性があります。
ゲルの崩れ
ゲル(特に濃度の低いもの)は柔らかいので、とても壊れやすいです。また、透明に近い見た目をしているため、穴や切れ目に気づきづらいです。そのため、以下のようなことが起こります。
- ウェルの底が破れていて、サンプルが漏れ出てしまった
- ウェルとウェルの間の壁が崩れていて、隣のウェルにサンプルが流れ出た
- ウェルの形がおかしくて、バンドもウェルの形に曲がってしまった
こうならないように、電気泳動を行う際は以下の点をチェックしましょう。
サンプル量が多い・少ない
ウェルに入れるサンプル量が多すぎると、バンドが太くなりすぎてぼんやりとしてしまい、正確な分子量を測定することが難しくなります。一方、少なすぎてもバンドが見えづらい、または見えないというトラブルの原因となります。
きれいな観察しやすいバンドになるDNA量は10ng〜200ng程度です。サンプル中のDNA量が分からない場合は、ウェルに入れる量を変えてみて、より良い結果が得られる量を探してみてください。
まとめ
この記事では、アガロースゲルを使った電気泳動によって、核酸(DNA・RNA)の大きさと量を測定する方法を紹介しました。
方法は次の5ステップです。
- ゲルを作る
- DNAサンプルをウェルに入れる
- 泳動する
- 臭化エチジウムで染色する
- 紫外線を当てて検出する
アガロースゲルの濃度を変えると、分離できる核酸の大きさが変わります。
また、電気泳動によって、以下の3つのことがわかります。
- 核酸の分子量
- おおよその量
- (トータルRNAの泳動では)RNAの品質
さらに、アガロースゲルから目的のバンドを切り出すことで、核酸を取り出して精製できます。
最後に、電気泳動でよくある失敗の原因を3つ解説しました。
- サンプルの分解
- ゲルの崩れ
- サンプル量が多い/少ない
核酸の電気泳動は分子生物学の研究でとてもよく使われる方法です。何度も読み返して、電気泳動法をマスターしていきましょう!