そんなあなたのために、博士号を持ち、日々の研究で免疫染色を行っている私が、その基本と実験工程をわかりやすく解説します。
この記事では、次のことを解説しています。
- 免疫染色でタンパク質の局在や分布など、空間情報がわかる
- 免疫染色は、抗原抗体反応を利用している
- 免疫染色には、蛍光抗体法、酵素抗体法、金属標識抗体法がある
- 免疫染色では、蛍光抗体法の間接法が最もよく使われている
- 免疫染色の流れは、「固定」、「包埋」、「ブロッキング」、「抗体反応」、「観察」
この記事を読めば、免疫染色の原理と実験方法がわかります。レポートや研究にも役立つので、一緒に学んでいきましょう!
免疫染色でタンパク質発現の空間情報がわかる
免疫染色(immunostaining)は、生体内の組織構成や細胞の特徴、構造を維持したまま目的タンパク質を可視化する手法です。生体内でタンパク質の機能を解析する際には、目的タンパク質の発現量や局在、分布を調べることが重要です。免疫染色を用いて組織や細胞を染色すると、目的タンパク質がいつどこで発現しているかがわかります。それらを調べることで、組織や細胞の状態を評価することができます。したがって免疫染色は、病理診断などの臨床現場でもよく用いられています。
免疫染色の基本原理
免疫染色は、抗原と抗体の特異的反応である抗原抗体反応を利用した実験手法です。研究サンプルを抗原(目的タンパク質)特異的な抗体(一次抗体)と反応させた後、一次抗体に特異的な抗体(二次抗体)と反応させます。二次抗体は、蛍光色素で標識されているものを用いるのが最も一般的で、共焦点顕微鏡などで蛍光シグナルを観察します。
免疫染色で組織を解析する場合は免疫組織化学染色(IHC: immunohistochemistry)と呼ばれ、細胞を解析する場合は免疫細胞化学染色(ICC: immunocytochemistry)と呼ばれます。両者とも実験手法は基本的に同じですが、IHCでは観察したいサンプルの切片(パラフィン切片や凍結切片)を作成するという点が異なります。
免疫染色でよく用いられる手法3選
蛍光抗体法
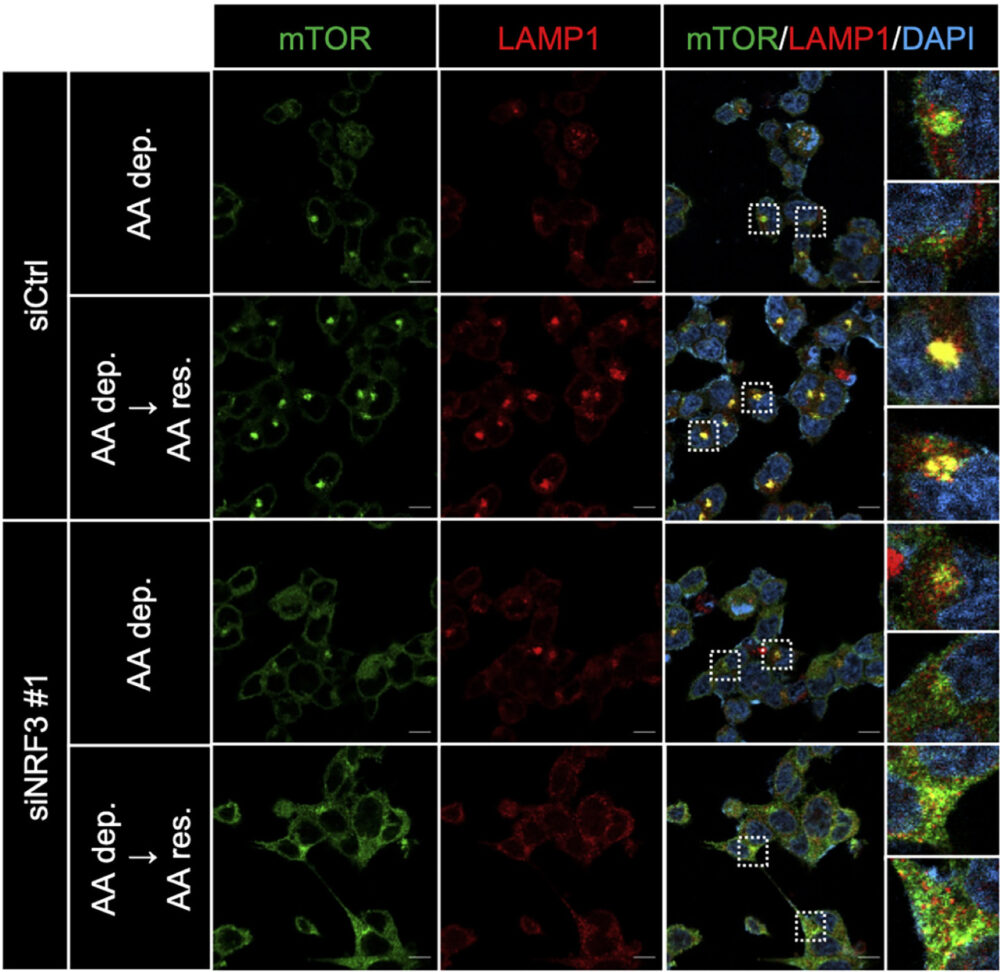
免疫染色で最もよく用いられる手法が蛍光抗体法です。蛍光色素で標識した抗体を用いて目的タンパク質を染色し、共焦点顕微鏡で観察します。ここでは、蛍光抗体法の検出方法について解説します。
直接法
目的タンパク質、抗原特異的な抗体(一次抗体)に、直接蛍光色素を標識した抗体を用いて染色する方法です。一次抗体が直接標識されているため、直接法と呼ばれます。この手法のメリットは、実験操作が簡単で作業時間が短いという点です。一方、デメリットは、抗原ごとに蛍光標識した抗体を準備しなければならない点と感度が低いという点です。
間接法
蛍光抗体法では、この間接法が最もよく用いられます。抗原(目的タンパク質)特異的な抗体(一次抗体)には蛍光標識せずに、一次抗体に特異的に結合する抗体(二次抗体)に蛍光色素を標識して検出する手法です。そうすることで検出感度が上がるというメリットがあります。一方、デメリットは、実験工程が増えるため、作業時間が長くなるという点です。
多重染色法
複数の抗原(目的タンパク質)を同時に染色して観察したい場合、この多重染色法が用いられます。実験方法は、基本的に間接法と同様です。この手法では、一次抗体反応において、複数(例えば2つ)の一次抗体を混合して反応させます。その後、励起波長の異なる蛍光色素で標識した2つの二次抗体を混合して反応させます。
注意点として、多重染色法で用いる一次抗体は、異なる動物種で作製されたものを用いる必要があります(それぞれマウス、ウサギ由来なら使用可能です)。そして二次抗体は、一次抗体を作製した動物とは異なる動物種で作製されたものを用いなければなりません(一次抗体がマウス、ウサギ由来で、二次抗体がヤギ由来なら使用可能です)。
この手法のメリットは、複数のタンパク質の局在を同時に観察できる点です。一方、デメリットは、異なる動物由来の一次抗体が必要なため、同時に使用できる抗体が制限されるという点です。
酵素抗体法
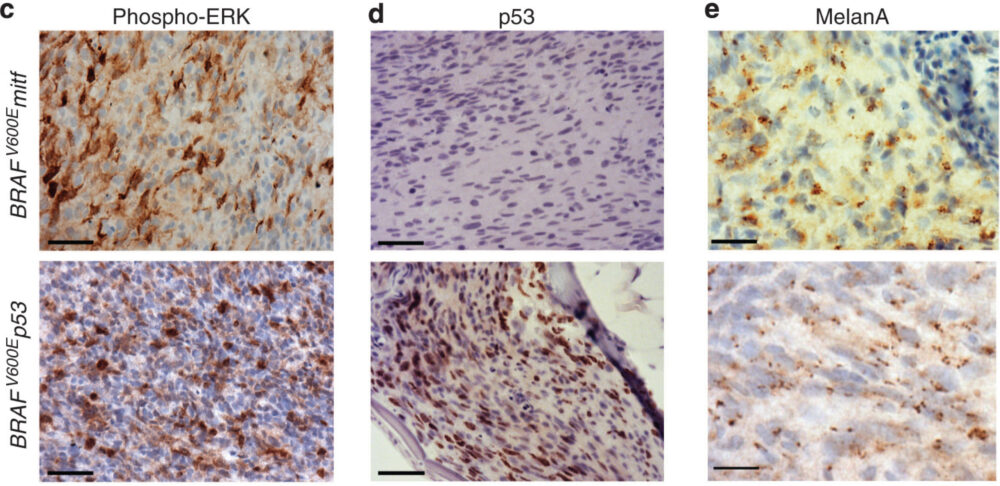
酵素抗体法は、西洋わさびペルオキシダーゼ(HRP)やアルカリフォスファターゼ(AP)などの酵素で標識された抗体を用いて目的タンパク質を可視化する手法です。HRP標識抗体の場合、抗体反応後にDAB(ジアミノベンチジン)基質溶液と反応させることで発色し、光学顕微鏡で観察できます。
酵素抗体法は古くから用いられている免疫染色手法ですが、病理学の分野を筆頭に現在でもよく用いられる方法の一つです。ここでは、その検出方法について解説します。
直接法
目的タンパク質、抗原特異的な抗体(一次抗体)に、直接酵素を標識した抗体を用いて染色します。一次抗体が直接標識されているため、直接法と呼ばれます。この手法のメリットは、実験操作が簡単で作業時間が短いという点です。一方、デメリットは、抗原ごとに酵素標識した抗体を準備しなければならない点と感度が低いという点です。
間接法
酵素抗体法で免疫染色を行う場合、この間接法を用いるのが一般的です。抗原(目的タンパク質)特異的な抗体(一次抗体)には標識せずに、一次抗体に特異的に結合する抗体(二次抗体)にHRPなどの酵素を標識して検出する手法です。そうすることで検出感度が上がるというメリットがあります。一方、デメリットは、実験工程が増えるため、作業時間が長くなるという点です。
ABC法
この手法は、ビタミンHとして知られているビオチン(biotin)と、ビオチンに強く結合するタンパク質であるアビジン(avidin)の特異的かつ強力な結合性を利用した方法です。アビジンとビオチンの複合体(avidin-biotin complex)を利用することから、ABC法と呼ばれます。
この手法では、抗原(目的タンパク質)特異的な一次抗体反応の後に、一次抗体に特異的に結合するビオチン化二次抗体を反応させます。次に、アビジンとペルオキシダーゼ標識ビオチンの複合体を反応させます(ABC反応と呼びます)。そして、DAB(ジアミノベンチジン)基質溶液と反応させることで発色します。この方法のメリットは、検出感度の高さと非特異的染色(バックグラウンド)を軽減できる点です。一方、デメリットは、実験工程が増えるため、作業時間が長くなるという点です。
LSAB(labeled streptavidin-biotin technique)法
ABC法を発展させたものがLSAB法です。実験手法は、基本的にABC法と同様ですが、アビジンとペルオキシダーゼ標識ビオチンの複合体を反応させる代わりに、ストレプトアビジンと西洋わさびペルオキシダーゼ(HRP)の複合体を反応させます。この手法では、ABC法よりもさらに高感度に抗原(目的タンパク質)の検出が可能です。
金属標識抗体法
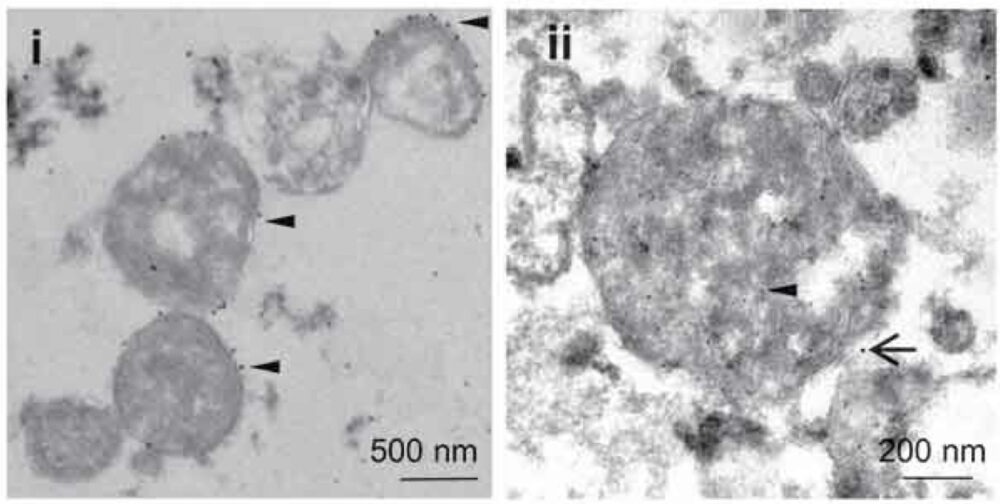
電子顕微鏡を用いた組織・細胞の観察で、免疫染色によって抗原(目的タンパク質)を可視化したい場合、金属標識抗体法が用いられます。金属標識抗体法では、研究サンプルの「包埋」、「超薄切片作製」、「免疫染色」をどの順序で行うかがキーポイントになり、サンプルの種類や観察目的に応じて変更する必要があります。ここでは、金属標識抗体法の中で最もよく用いられる手法である金コロイド標識法について解説します。
金コロイド標識法
この手法は、金コロイドで標識した二次抗体を用いて抗原(目的タンパク質)を検出する方法です。サンプルを「固定」、「包埋」、「超薄切片作製」、「免疫染色」、「電子染色」の順番で処理するポストエンベッディング法(包埋の後に免疫染色する方法)を用いて染色します。免疫染色時には、まず抗原特異的な一次抗体を反応させます。そして、一次抗体を特異的に認識する二次抗体には金コロイドで標識したものを用います。
他の免疫電顕法と比べて、この方法は定量性が高いという点と二重染色が可能である点がメリットです。一方、デメリットは、作業工程中に抗原の変性が起きやすく、再現を取るのがやや難しい点です。
【手法別】免疫染色手法の使い分け方
免疫染色手法の使い分け方について、日々の実験で免疫染色を行っている私の考え方を紹介します。
✓蛍光抗体法が向いている場合
- 複数のタンパク質の局在を同時に観察したい
- 切片を作らず厚みのあるサンプルを共焦点観察したい
- 視覚的にタンパク質の局在が理解しやすいイメージングをしたい
✓酵素抗体法が向いている場合
- 発現量が微量なタンパク質の局在を観察したい
- 病理組織など、貴重な試料を観察したい
✓金属標識抗体法が向いている場合
- 細胞内小器官に局在するタンパク質を観察したい
組織・細胞蛍光免疫染色の工程を解説
研究室で最もよく使われる免疫染色手法である蛍光抗体法について、組織・細胞サンプル別にその実験工程を解説します。
組織の蛍光免疫染色(間接法)
1. 組織の固定
解剖した組織をホルマリン等の固定液で化学的に固定します。この処理により、組織の形態が保持され、抗原の移動・流出が防止できます。組織のサイズは、固定液が浸透しやすいように5mm角程度が望ましいです。
2. 包埋と組織切片の作製(パラフィン切片の場合)
固定した組織を濃度の異なるエタノール(低濃度→高濃度)に浸し、脱水処理を行います。次に、クロロホルムに浸して、組織内のエタノールを置換します(エタノールはパラフィンと混ざらないため)。その後、パラフィンに包埋します。
パラフィンブロックをミクロトームで薄切し、スライドガラス上に進展させます。次に、キシレン、濃度の異なるエタノール(高濃度→低濃度)に浸して、脱パラフィン処理を行います。
3. 抗原賦活化
ホルマリン固定によって隠されてしまった抗原を再び露出させ、抗体がアクセスしやすいようにする手法が抗原賦活化です。加熱処理やプロテアーゼ処理を行います。
4. ブロッキング
使用する抗体が目的の抗原以外に結合するのを防ぐため、ブロッキング溶液でスライドガラスを覆ってインキュベートします。ブロッキング溶液には、ウシ血清アルブミン(BSA)を含む溶液、または二次抗体を作製した動物種の血清を含む溶液を用います。後者の方が、ブロッキングの効果が強いです。
5. 抗体反応
BSAを含む溶液で希釈した一次抗体溶液でスライドガラスを覆ってインキュベートします。4℃で一晩処理すると、綺麗な染色像を得られることが多いです。
洗浄後、BSAを含む溶液で希釈した蛍光標識二次抗体溶液でスライドガラスを覆い、遮光してインキュベートします。蛍光標識二次抗体は、15,000 rpmで5分間遠心してから上清を採取します。そうすることで、顆粒状の非特異的な蛍光シグナルの発生を予防できます。
6. マウントと観察
洗浄後、スライドガラス上にマウント剤(VECTASHIELDなど)を適量滴下し、気泡が入らないようにカバーガラスを被せてマウントします。最後に、共焦点顕微鏡などを用いて試料を観察します。
細胞の蛍光免疫染色(間接法)
1. 試料の準備
12ウェルプレートなどにカバーガラスを入れ、その上から細胞を播種して培養し、カバーガラス上に細胞を付着させます。
2. 細胞の固定
細胞が付着したカバーガラスが入ったウェルにホルムアルデヒド(またはパラホルムアルデヒド)溶液を加え、細胞を化学的に固定します。この処理により、細胞の形態が保持され、抗原の移動・流出が防止できます。
3. 膜透過処理
洗浄後、細胞が付着したカバーガラスが入ったウェルに界面活性剤(Triton X-100など)を含む膜透過液を加え、インキュベートします。この処理によって、細胞質や核に局在する抗原に抗体がアクセスしやすくなります。
4. ブロッキング
細胞が付着したカバーガラスをピンセットで取り出し、細胞が上になる状態でウェルの蓋に置きます。
使用する抗体が目的の抗原以外に結合するのを防ぐため、ブロッキング溶液でカバーガラスを覆ってインキュベートします。その後、カバーガラスをウェルに戻し洗浄します。ブロッキング溶液には、ウシ血清アルブミン(BSA)を含む溶液、または二次抗体を作製した動物種の血清を含む溶液を用います。後者の方が、ブロッキングの効果が強いです。
5. 抗体反応
カバーガラスを取り出し、BSAを含む溶液で希釈した一次抗体溶液で覆ってインキュベートします。4℃で一晩処理すると、綺麗な染色像を得られることが多いです。
カバーガラスをウェルに戻して洗浄後、再度取り出し、BSAを含む溶液で希釈した蛍光標識二次抗体溶液で覆い、遮光してインキュベートします。その後、カバーガラスをウェルに戻して洗浄します。蛍光標識二次抗体は、15,000 rpmで5分間遠心してから上清を採取します。そうすることで、顆粒状の非特異的な蛍光シグナルの発生を予防できます。
6. マウントと観察
スライドガラス上にマウント剤(VECTASHIELDなど)を適量滴下し、細胞が付着した面を下にした状態でカバーガラスを被せてマウントします。その際、気泡が入らないように注意します。最後に、共焦点顕微鏡などを用いて試料を観察します。
免疫染色のメリット、デメリット
蛍光抗体法
酵素抗体法
金属標識抗体法(金コロイド標識法)
まとめ
この記事では、免疫染色の基本と具体的な実験工程を解説しました。
- 免疫染色でタンパク質の局在や分布など、空間情報がわかる
- 免疫染色は、抗原抗体反応を利用している
- 免疫染色には、蛍光抗体法、酵素抗体法、金属標識抗体法がある
- 免疫染色では、蛍光抗体法の間接法が最もよく使われている
- 免疫染色の流れは、「固定」、「包埋」、「ブロッキング」、「抗体反応」、「観察」
タンパク質を検出・定量する他の方法については、下記記事にて紹介しています。