皆さんはELISA法(Enzyme Linked Immuno Sorbent Assay)について説明できますか?また、実際にELISA法でタンパク質を検出、定量することができますか?
今回はこのような悩みを持つ学生の方に向けて、ELISAでの検出・定量の原理、実際の方法、メリットとデメリット、失敗とトラブルシューティングをまとめました。この記事を読んで、講義で学んだELISAを復習し実際に目的のタンパク質を定量できることを目指しましょう。
ELISA法の目的はタンパク質の検出、定量
ELISA法の目的は、試料溶液中に含まれる目的タンパク質の検出と定量です。細胞内で遺伝子情報が実際に発現する際、DNAから転写されたmRNAをもとに、タンパク質が翻訳(合成)されます。そして、タンパク質の種類によっては組織や細胞から分泌されるものもあります。ELISA法では組織や細胞から抽出したタンパク質の他に、細胞から細胞培養液中などの試料溶液中に分泌された目的タンパク質を検出・定量することを目的にしています。
ELISA法の原理は抗体と酵素を利用して検出、定量する
ELISA法の原理は抗体により目的タンパク質を特異的に選択し、酵素による発色を利用して、目的タンパク質を検出、定量します。ELISA法では、初めに目的タンパク質をマイクロプレートに固相化(固定)します。次に酵素標識された抗体をマイクロプレートに固相化したタンパク質に結合させます。最後に、基質溶液を加えて酵素反応により発色させます。そして、吸光度を測定することで目的タンパク質を検出します。
また、吸光度はランベルト・ベールの法則に従い、濃度に比例します。目的タンパク質が多い場合、結合する抗体と酵素の量も比例して増加します。そのため、反応した基質溶液から発色する化合物の濃度が高いほど吸光度も高くなります。その結果、吸光度の強さにより目的タンパク質の定量もできます。
ELISA法の4つの種類とその方法
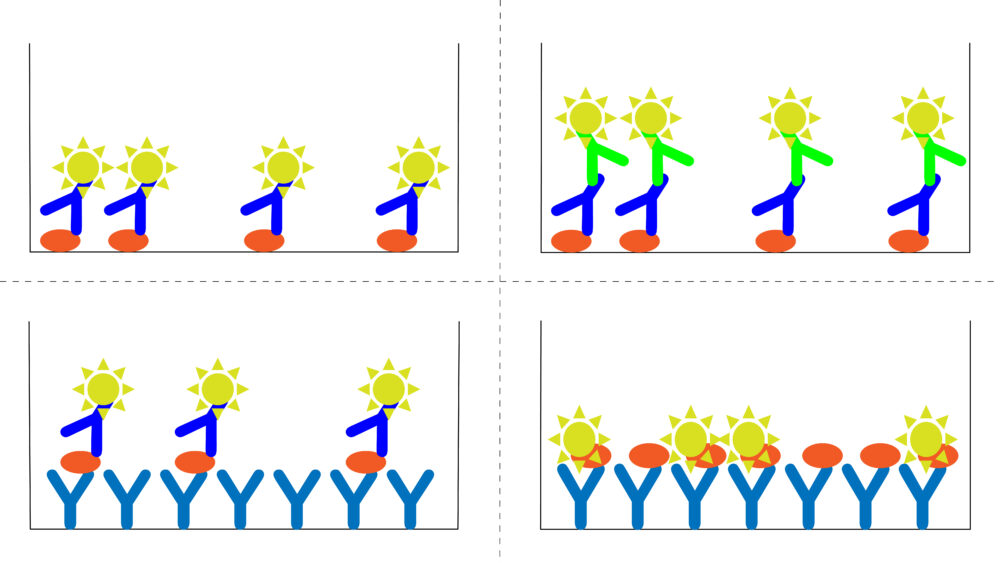
ELISA法はマイクロプレートへの目的タンパク質の固相化や検出方法により4種類に分類されます。今回はこれら4つの方法を紹介します。
直接法
直接法では、目的タンパク質を直接マイクロプレートに固相化し、酵素標識した一次抗体を用いて検出します。
直接法のメリットは、作業工程が少なく、他の方法より迅速に結果が得られます。
一方、直接法のデメリットは、バックグラウンドが高くなりやすいことです。抗原の固相化が非特異的であるため、サンドイッチ法(固相化した抗体により目的タンパク質を固定する方法)と比較し、マイクロプレートへの非特異的な結合が多くなる可能性があります。そのため、バックグラウンドが高くなりやすいです。また、目的タンパク質に対する特異的な酵素標識された抗体が必要になります。
間接法
間接法では、直接マイクロプレートに固相化した目的タンパク質に特異的な一次抗体を結合させ、さらに一次抗体に結合する酵素標識された二次抗体を用いて検出します。
間接法のメリットは、酵素標識された抗体を、目的タンパク質ごとに準備する必要がないことです。そのため、抗体作成の費用や手間も少ないです。
一方、間接法のデメリットは、作業工程が直接法より多く、結果を得るのに少し時間がかかる点です。
サンドイッチ法
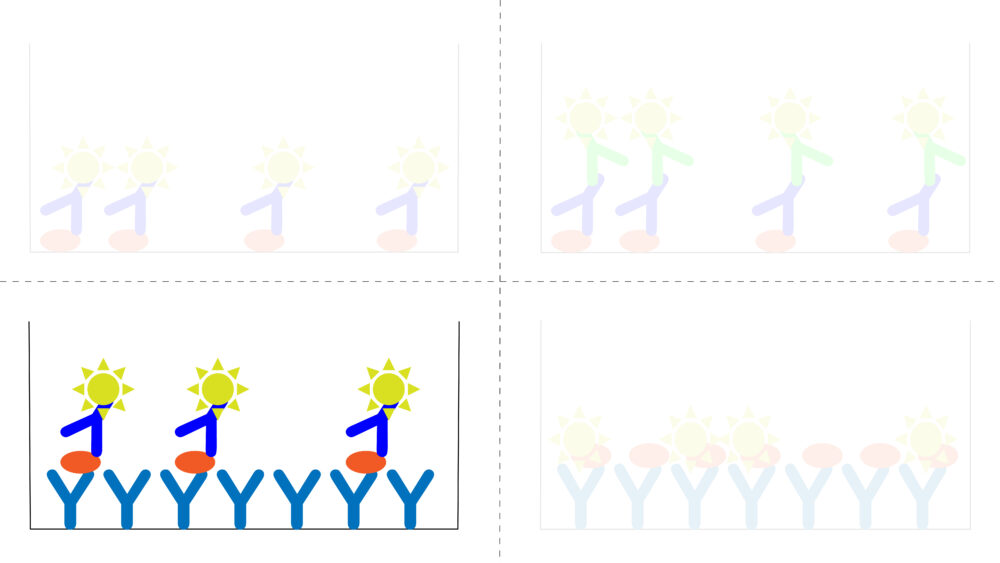
サンドイッチ法では、目的タンパク質に特異的な抗体をもちいてマイクロプレートに固定します。そして、酵素標識された抗体を用いて検出します。サンドイッチ法では、マイクロプレートに固定するのに用いる抗体と検出に用いる抗体の抗原認識部位は異なる必要があります。
サンドイッチ法のメリットは検出、定量の特異度が高いことです。抗原認識部位の異なる2つの抗体を組み合わせることにより、一種類の抗体のみで行う直接法や間接法より反応の得意度が高くなります。
一方、サンドイッチ法のデメリットは、分子量の小さなタンパク質の測定が困難な点です。サンドイッチ法では、抗原認識部位の異なる2つの抗体を組み合わせて行います。そのため、目的タンパク質に2つ以上の抗体結合部位のない低分子タンパク質の検出、定量が困難です。
競合法
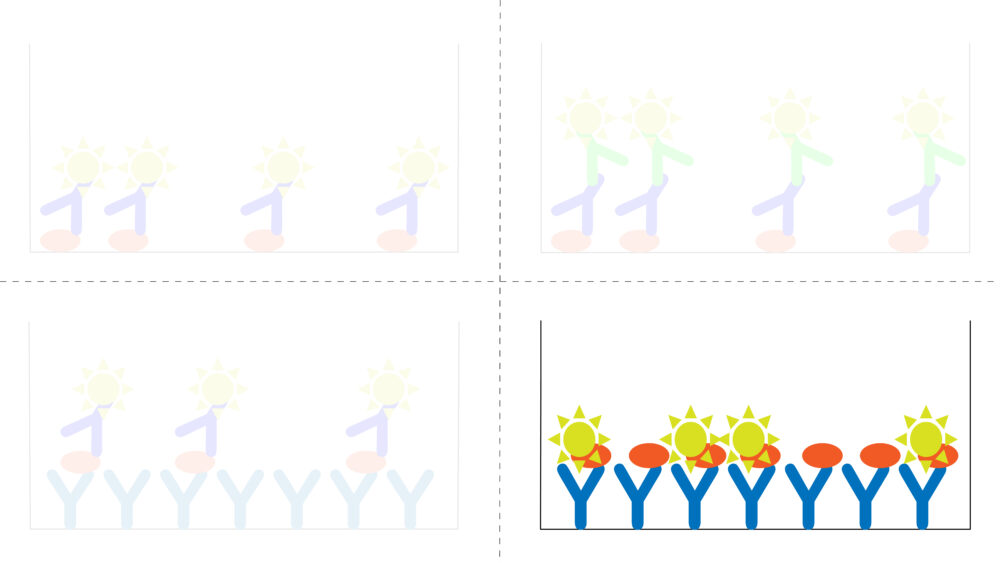
競合法では、目的タンパク質に特異的な抗体をマイクロプレートに固相化します。検出、定量したい目的タンパク質を含む資料溶液と濃度が既知の酵素標識されたタンパク質(目的タンパク質と同一のタンパク質)を、同じマイクロプレートに加えて抗体と反応させます。その後、酵素活性を検出し、目的タンパク質を定量します。サンプル中の目的タンパク質が多い場合、抗体と結合できる酵素標識したタンパク質が少なくなり、吸光度は小さくなります。一方、サンプル中の目的タンパク質が少ない場合、抗体と結合できる酵素標識されたタンパク質が多くなり、吸光度は大きくなります。その結果、試料中の目的タンパク質量と吸光度の関係は反比例になります。
競合法のメリットはサンドイッチ法では測定できない、分子量の小さなタンパク質の測定が可能な点です。競合法では、抗原認識部位は1つで良いため、低分子のタンパク質でも検出、定量が可能です。
一方、競合法のデメリットは酵素標識された目的タンパク質を合成する必要がある点です。そのため、酵素標識されたタンパク質を合成する分の費用や手間が必要になります。
4種類のELISA法の工程を解説
4種類のELISA法の工程について解説します。
直接法の工程
直接法では、目的タンパク質を直接マイクロプレートに固相化し、酵素標識した一次抗体を用いて検出します。
- タンパク質を直接マイクロプレートに固相化
- 酵素標識された抗体の結合
- 酵素による発色と吸光度による検出
- 検量線の作成と定量
1. タンパク質を直接マイクロプレートに固相化
直接法では、目的タンパク質を直接マイクロプレートに固相化します。ELISA法に用いるマイクロプレートの底の部分にはタンパク質を固相化できるように加工されています。マイクロプレートは測定する目的タンパク質により使い分けます。分子量の小さいタンパク質は共有結合により固相化します。その場合に使用するマイクロプレートの底は、アミノ基やカルボキシル基などの親水基でコーティングされています。一方、分子量の大きなタンパク質は疎水性相互作用により固相化します。その場合に用いるマイクロプレートの底は、疎水基でコーティングされています。
次に、目的タンパク質の非特異的な結合を防ぐためにブロッキングを行います。ブロッキングにはスキムミルクやBSAなどのタンパク質溶液が用いられます。その後、ブロッキングに用いた溶液を除き、数回洗浄します。
2. 酵素標識された抗体の結合
次に酵素標識された一次抗体を結合させます。標識に用いられる酵素には、主に西洋わさびペルオキシダーゼが用いられます。
3. 酵素による発色と吸光度による検出
基質溶液を加えて発色させ、吸光度を測定します。マイクロプレートに基質溶液を加えて発色させます。その後、反応停止液を加えます。反応停止液は酵素による発色を停止するために使用します。酵素による発色は基質溶液がある限り継続する可能性があります。そのため、一定時間が経過した後、反応停止液(主に酸)を加え、酵素を失活させ反応を停止させます。
最後に吸光度を測定します。吸光度は酵素による発色に比例して大きくなるため、目的タンパク質が多いほど吸光度は大きくなります。
4. 検量線の作成と定量
目的タンパク質の標準物質を用いて検量線を作成し、サンプル中の目的タンパク質を定量します。このとき、検量線の作成に用いる目的タンパク質の濃度の上限と下限は吸光度とタンパク質の濃度が比例関係になるように設定する必要があります。最後に、得られた目的タンパク質の吸光度と作成した検量線を用いてサンプル中の目的タンパク質の定量を行います。
間接法の工程
間接法では、直接マイクロプレートに固相化した目的タンパク質に特異的な一次抗体を結合させ、さらに一次抗体に結合する酵素標識された二次抗体を用いて検出します。
- タンパク質を直接マイクロプレートに固相化
- 一次抗体と二次抗体の結合
- 酵素による発色と吸光度による検出
- 検量線の作成と定量
1. タンパク質を直接マイクロプレートに固相化
間接法では、目的タンパク質を直接マイクロプレートに固相化します。ELISA法に用いるマイクロプレートの底の部分にはタンパク質を固相化できるように加工されています。マイクロプレートは測定する目的タンパク質により使い分けます。分子量の小さいタンパク質は共有結合により固相化します。その場合に使用するマイクロプレートの底は、アミノ基やカルボキシル基などの親水基でコーティングされています。一方、分子量の大きなタンパク質は疎水性相互作用により固相化します。その場合に用いるマイクロプレートの底は、疎水基でコーティングされています。
次に、目的タンパク質の非特異的な結合を防ぐためにブロッキングを行います。ブロッキングにはスキムミルクやBSAなどのタンパク質溶液が用いられます。その後、ブロッキングに用いた溶液を除き、数回洗浄します。
2. 一次抗体と二次抗体の結合
まず、目的タンパク質と特異的に結合する一次抗体を結合させます。次に一次抗体と特異的に結合する酵素標識された二次抗体を結合させます。標識に用いられる酵素には、主に西洋わさびペルオキシダーゼが用いられます。
3. 酵素による発色と吸光度による検出
基質溶液を加えて発色させ、吸光度を測定します。マイクロプレートに基質溶液を加えて発色させます。その後、反応停止液を加えます。反応停止液は酵素による発色を停止するために使用します。酵素による発色は基質溶液がある限り継続する可能性があります。そのため、一定時間が経過した後、反応停止液(主に酸)を加え、酵素を失活させ反応を停止させます。
最後に吸光度を測定します。吸光度は酵素による発色に比例して大きくなるため、目的タンパク質が多いほど吸光度は大きくなります。
4. 検量線の作成と定量
目的タンパク質の標準物質を用いて検量線を作成し、サンプル中の目的タンパク質を定量します。このとき、検量線の作成に用いる目的タンパク質の濃度の上限と下限は吸光度とタンパク質の濃度が比例関係になるように設定する必要があります。最後に、得られた目的タンパク質の吸光度と作成した検量線を用いてサンプル中の目的タンパク質の定量を行います。
サンドイッチ法(直接サンドイッチ法)の工程
サンドイッチ法では、目的タンパク質に特異的な抗体をもちいてマイクロプレートに固定します。そして、酵素標識された抗体を用いて検出します。
- 抗体を介してタンパク質をマイクロプレートに固定
- 酵素標識された抗体の結合
- 酵素による発色と吸光度による検出
- 検量線の作成と定量
1.抗体を介してタンパク質をマイクロプレートに固定
マイクロプレートに抗体を固相化し、目的タンパク質を抗原抗体反応により固定します。この方法では、初めに目的タンパク質に特異的な抗体の希釈液をマイクロプレートに加え、固相化します。その後、抗体希釈液を除き、数回洗浄します。
次に、目的タンパク質の非特異的な結合を防ぐためにブロッキングを行います。ブロッキングにはスキムミルクやBSAなどのタンパク質溶液が用いられます。その後、ブロッキングに用いた溶液を除き、数回洗浄したマイクロプレートに目的タンパク質溶液を加え、マイクロプレートに固定します。
2.酵素標識された抗体の結合
マイクロプレートに固定した目的タンパク質に酵素標識された抗体を結合させます。標識に用いられる酵素には、主に西洋わさびペルオキシダーゼが用いられます。サンドイッチ法では一般的に、酵素標識された一次抗体を結合させます(直接サンドイッチ法)。しかし、一次抗体と酵素標識された二次抗体を結合させる方法(間接サンドイッチ法)が用いられる場合もあります。
3. 酵素による発色と吸光度による検出
基質溶液を加えて発色させ、吸光度を測定します。マイクロプレートに基質溶液を加えて発色させます。その後、反応停止液を加えます。反応停止液は酵素による発色を停止するために使用します。酵素による発色は基質溶液がある限り継続する可能性があります。そのため、一定時間が経過した後、反応停止液(主に酸)を加え、酵素を失活させ反応を停止させます。
最後に吸光度を測定します。吸光度は酵素による発色に比例して大きくなるため、目的タンパク質が多いほど吸光度は大きくなります。
4. 検量線の作成と定量
目的タンパク質の標準物質を用いて検量線を作成し、サンプル中の目的タンパク質を定量します。このとき、検量線の作成に用いる目的タンパク質の濃度の上限と下限は吸光度とタンパク質の濃度が比例関係になるように設定する必要があります。最後に、得られた目的タンパク質の吸光度と作成した検量線を用いてサンプル中の目的タンパク質の定量を行います。
競合法の工程
競合法では、目的タンパク質に特異的な抗体をもちいてマイクロプレートに固定します。そして、定量したい目的タンパク質を含む資料溶液と濃度が既知の酵素標識されたタンパク質(目的タンパク質と同一のタンパク質)を用いて検出します。
- 抗体を介してタンパク質をマイクロプレートに固定
- 酵素標識したタンパク質の結合
- 酵素による発色と吸光度による検出
- 検量線の作成と定量
1.抗体を介してタンパク質をマイクロプレートに固定
マイクロプレートに抗体を固相化し、目的タンパク質を抗原抗体反応により固定します。この方法では、初めに目的タンパク質に特異的な抗体の希釈液をマイクロプレートに加え、固相化します。その後、抗体希釈液を除き、数回洗浄します。
次に、目的タンパク質の非特異的な結合を防ぐためにブロッキングを行います。ブロッキングにはスキムミルクやBSAなどのタンパク質溶液が用いられます。その後、ブロッキングに用いた溶液を除き、数回洗浄したマイクロプレートに目的タンパク質溶液を加え、マイクロプレートに固定します。
2.酵素標識したタンパク質の結合
サンプルの目的タンパク質と同時に、酵素標識されえた目的タンパク質(標準物質)を加えます。標識に用いられる酵素には、主に西洋わさびペルオキシダーゼが用いられます。
3. 酵素による発色と吸光度による検出
基質溶液を加えて発色させ、吸光度を測定します。マイクロプレートに基質溶液を加えて発色させます。その後、反応停止液を加えます。反応停止液は酵素による発色を停止するために使用します。酵素による発色は基質溶液がある限り継続する可能性があります。そのため、一定時間が経過した後、反応停止液(主に酸)を加え、酵素を失活させ反応を停止させます。
最後に吸光度を測定します。吸光度は酵素による発色に比例して大きくなるため、目的タンパク質が多いほど吸光度は大きくなります。
4. 検量線の作成と定量
目的タンパク質の標準物質を用いて検量線を作成し、サンプル中の目的タンパク質を定量します。このとき、検量線の作成に用いる目的タンパク質の濃度の上限と下限は吸光度とタンパク質の濃度が比例関係になるように設定する必要があります。最後に、得られた目的タンパク質の吸光度と作成した検量線を用いてサンプル中の目的タンパク質の定量を行います。
ELISA法のメリットとデメリット
特定のタンパク質を検出、定量する方法には、ELISA法以外にもいくつかの方法があります。他の方法についてはこちらの記事をご確認ください。ここでは、これら他の方法と比較した、ELISA法のメリット・デメリットを解説します。

ELISA法のメリット3選
測定の特異度が高い
ELISA法のメリットの一つに測定の特異度が高いことが挙げられます。ELISA法は抗体を用いて特異的に目的タンパク質を認識しているため、高い特異性を示すことができます。特に、間接法やサンドイッチ法では複数の種類の抗体を用いて目的タンパク質を認識するため、より高い特異度で検出や定量をすることが可能です。
翻訳後修飾されたタンパク質の検出も可能
ELISA法では、リン酸化やメチル化など、翻訳後修飾されたタンパク質も検出できます。次抗体には、リン酸化やメチル化など特定の修飾がされたタンパク質にのみ反応するものもあるためです。タンパク質には、翻訳後修飾で活性が調節されているものもあります。修飾されたタンパク質を特異的に検出することで、そのタンパク質の活性状態などを調べることが可能です。
測定時間が比較的短い
ELISA法ではタンパク質の固相化に1時間ほど、抗体との反応に1時間ほどかかります。最後の酵素による発色と吸光度の測定も1時間あれば十分です。そのため、ELISA法によるタンパク質の定量は半日もあれば完了できます。
ELISA法のデメリット3選
目的タンパク質の分子量がわからない
ELISA法ではタンパク質の分子量がわかりません。ELISA法は抗体と酵素を用いて目的タンパク質の検出と定量を行います。しかし、これらの反応ではタンパク質の分子量が影響を及ぼすことはありません。そのため、ELISA法では目的タンパク質の分子量を測定できません。
1検体で1つのタンパク質しか測定できない
ELISA法では、1検体で1つのタンパク質しか測定できません。直接法や間接法では、基質溶液を加えて発色させた後に抗体を除去し、別の抗体を結合させることはできません。また、サンドイッチ法や競合法では抗体を用いて、マイクロプレートにタンパク質を固相化した後に他のタンパク質を洗浄します。そのため、1検体からは目的タンパク質以外を測定することはできません。ELISA法では1検体で1つのタンパク質しか測定できず、別のタンパク質を検出、定量する場合は、測定を初めからやり直す必要があります。
微量な差を検出しにくい
ELISA法の定量は、酵素による発色の吸光度を測定、比較することで行います。しかし、目的タンパク質量の差が小さい場合、その差が吸光度の差が小さく、比較できない場合もあります。そのため、ELISA法では、目的タンパク質の微量な差を検出することは困難です。



ELISA法の失敗8選とそのトラブルシューティング
- ネガティブコントロールで発色を認める
- バックグラウンドが高い
- 全体的に吸光度が小さい
- 吸光度が大きい
- 同一サンプル間でデータのばらつきが大きい
- 発色するのに時間がかかる
- 発色がうまくいかない(発色しない)
- 検量線がうまく引けない
ネガティブコントロールで発色を認める
- コンタミネーションの可能性
- 酵素標識された抗体の非特異的な結合
コンタミネーションの可能性
マイクロプレートのネガティブコントロールを加えた場所に誤って、サンプルが入り込んだことによるコンタミネーションの可能性があります。例えば、ピペット操作時のミスやピペットのチップの交換を忘れたことなどの理由が考えられます。対策として、コンタミネーションが起こらないよう、ピペット操作は正確に注意深く行いましょう。また、ピペットのチップはサンプルごとに必ず交換しましょう。
酵素標識された抗体の非特異的な結合
サンドイッチ法の場合、目的タンパク質を固定するための抗体と酵素標識された抗体との非特異的な結合の可能性が考えられます。対策として、使用する抗体を変更する、または洗浄の時に洗浄液の量や、洗浄回数を増やすことで改善できる可能性があります。
バックグラウンドが高い
- 酵素標識された抗体の非特異的な結合
- 抗体の濃度が高い
- 抗体や基質溶液の反応時間が長い
- 酵素反応が停止していない
- 反応停止から吸光度測定までの時間が長い
酵素標識された抗体の非特異的な結合
非特異的な結合の原因には、ブロッキングが不十分で、マイクロプレートに直接、抗体が非特異的に結合したことが考えられます。対策として、ブロッキングに用いるタンパク質溶液の濃度を上げる、またはブロッキング剤の種類を変えることで改善する場合があります。また、ブロッキングにかける時間を増やすことで改善できる可能性もあります。
他には、サンドイッチ法では、目的タンパク質を固定するための抗体と酵素標識された抗体との非特異的な結合の可能性が考えられます。ネガティブコントロールでも吸光度が高い場合、この可能性が考えられます。対策として、使用する抗体を変更する、または洗浄の時に洗浄液の量や、洗浄回数を増やすことで改善できる可能性があります。
抗体の濃度が高い
抗体反応の時、抗体の濃度が高く、マイクロプレートと抗体が非特異的に結合している可能性が考えられます。対策として、反応に用いる抗体の濃度を低くすることで改善します。
抗体や基質溶液の反応時間が長い
抗体や基質溶液の反応時間が長いため、抗体の非特異的な結合が多くなる、または発色が強くなる可能性が考えられます。対策として、抗体や基質溶液の反応時間を短くすることで改善する可能性があります。
酵素反応が停止していない
基質溶液と酵素の反応が完全に停止していない可能性が考えられます。反応停止液は主に酸です。しかし、酸は古くなると劣化し、酵素反応を停止できていない可能性があります。対策として、反応停止液を新しい物にすることで改善する可能性があります。
反応停止から吸光度測定までの時間が長い
反応停止液を加えてから、吸光度を測定するまでの時間が長いことが原因の可能性があります。基質溶液には、反応停止液を加えてからも時間の経過とともに発色が濃くなるものがあります。対策として、反応停止液を加えたら時間を置かずに吸光度を測定することで改善する可能性があります。
全体的に吸光度が小さい
- サンプル中の目的タンパク質の量が少ない
- 酵素反応を阻害する物質の混入
- 抗体の結合が不十分
- 酵素反応の条件が不適切
- 反応停止液が古い
- 反応停止から吸光度測定までの時間が長い
サンプルのタンパク質の量が少ない
目的タンパク質の発現量が少ないと考えられる場合、タンパク質の抽出量を増やす、抽出に用いる溶液または、試薬の量を減らす(サンプル中のタンパク質濃度を濃くする)ことで改善します。また、サンプル細胞の溶解に用いるLysis bufferによって目的のタンパク質が可溶化されていない可能性が考えられます。その場合、サンプル細胞の溶解条件を変えることで改善できる可能性があります。
酵素反応を阻害する物質の混入
西洋わさびペルオキシダーゼによる発色反応はアジ化ナトリウムにより阻害されます。アジ化ナトリウムは抗体製品の防腐剤として添加されている場合があります。対策として、アジ化ナトリウムを含まない抗体製品を使用することで改善する可能性があります。
抗体の結合が不十分
抗体の結合には、タンパク質側に原因がある場合と、抗体側に原因がある場合があります。
タンパク質側の原因として、タンパク質の抽出の工程で過剰な熱が加わることで抗原性が失われた可能性があります。対策として、タンパク質サンプルを冷やしながら取り扱うことが挙げられます。
また、抗体側の原因として、抗体反応に用いる抗体の量が不足している可能性があります。その場合、抗体の量を増やすことで改善します。
酵素反応の条件が不適切
酵素には反応が効率よく進む最適温度があります。そのため、酵素反応をさせる環境や反応溶液の温度が不適切な場合、発色反応が十分に行われません。対策として、発色反応を行う温度を酵素の最適温度に保つことで改善する可能性があります。また、基質溶液を冷蔵または、冷凍で保管していた場合、室温に戻してから使用してください。
他には、反応時間が短いことが考えられます。対策として、反応時間を長くすることで改善する可能性があります。
反応停止液が古い
反応停止液が古い可能性があります。反応停止液は主に酸です。しかし、酸は古くなると劣化し酸性度が低下している可能性があります。基質溶液の中には反応停止液を加え、Hpを調整することで既定の吸光度の発色を示すものがあります。そのため、Hpが規定の範囲外の場合、発色が不十分になります。対策として、反応停止液を新しい物にすることで改善する可能性があります。
反応停止から吸光度測定までの時間が長い
反応停止液を加えてから、吸光度を測定するまでの時間が長いことが原因の可能性があります。基質溶液には、反応停止液を加えてからの時間経過とともに発色が薄くなるものがあります。対策として、反応停止液を加えたら時間をおかずに吸光度を測定することで改善する可能性があります。
吸光度が大きい
ネガティブコントロールやバックグラウンドが正常でも、サンプルを加えた箇所の吸光度が大きい場合、原因には以下が考えられます。
- サンプル中の目的タンパク質の量が多い
- 抗体の濃度が高い
- 抗体や基質溶液の反応時間が長い
- 酵素反応が停止していない
- 反応停止から吸光度測定までの時間が長い
サンプル中の目的タンパク質の量が多い
対策として、試料溶液中の目的タンパク質濃度を低くするため、サンプルを希釈することで改善します。
抗体の濃度が高い
抗体反応の時、抗体の濃度が高く、目的タンパク質あたりの結合している抗体量が多い可能性があります。または、サンドイッチ法でマイクロプレートに固定する抗体量が多い可能性が考えられます。対策として、使用する抗体溶液の濃度を低くすることで改善する可能性があります。
抗体や基質溶液の反応時間が長い
抗体や基質溶液の反応時間が長いため、目的タンパク質と抗体の結合が多くなる、または酵素反応の時間が長くなり発色が強くなる可能性が考えられます。対策として、抗体や基質溶液の反応時間を短くすることで改善する可能性があります。
酵素反応が停止していない
基質溶液と酵素の反応が完全に停止していない可能性が考えられます。反応停止液は主に酸です。しかし、酸は古くなると劣化し、酵素反応を停止できていない可能性があります。対策として、反応停止液を新しい物にすることで改善する可能性があります。
反応停止から吸光度測定までの時間が長い
反応停止液を加えてから、吸光度を測定するまでの時間が長いことが原因の可能性があります。基質溶液には、反応停止液を加えてからも時間の経過とともに発色が濃くなるものがあります。対策として、反応停止液を加えたら時間を置かずに吸光度を測定することで改善する可能性があります。
同一サンプル間でデータのばらつきが大きい
- マイクロプレートの固相化が不均一
- コンタミネーションの可能性
- 反応に用いる試薬、溶液が不均一
- 洗浄液の量が不均一、不十分
- マイクロプレート内の液体の蒸発
- マイクロプレートの底が汚れている
マイクロプレートへの固相化が不均一
マイクロプレートへの固相化が不均一となる原因として、固相化するタンパク質や抗体に対して適切なコーティングのマイクロプレートを使用していない可能性があります。対策として、実験系に適切なコーティングのマイクロプレートに変更することで改善する可能性があります。
コンタミネーションの可能性
マイクロプレートのウェル間でサンプルのコンタミネーションが生じた可能性があります。例えば、ピペット操作時のミスやピペットのチップの交換を忘れたことなどの理由が考えられます。対策として、コンタミネーションが起こらないよう、ピペット操作は正確に注意深く行いましょう。また、ピペットのチップはサンプルごとに必ず交換しましょう。
他には、抗体や基質溶液と反応させる時にマイクロプレートに専用のカバーの使用で改善する可能性があります。カバーの使用により、ウェル間でのサンプルのコンタミネーションを防止できます。
反応に用いる試薬、溶液が不均一
反応に用いる試薬、溶液が不均一なため、マイクロプレートのウェル毎に試薬濃度が変わったため生じた可能性があります。対策として、試薬やサンプルの濃度が不均一にならないよう、プレートに滴下する前に十分に混和することで改善します。
洗浄液の量が不均一、不十分
マイクロプレートのウェル毎に洗浄液の量が異なるまたは、不足している場合、洗浄が均一に行われず反応が均一に進まない可能性があります。対策として、洗浄の際にはマイクロプレートのウェル間で洗浄液量に差が出ないよう、連続分注器やマルチピペットを用いることで改善する可能性があります。
マイクロプレート内の液体の蒸発
反応を進める過程で、マイクロプレート内の液体が蒸発し、ウェル毎の溶液濃度が変化し、同一サンプル間でも差が生じた可能性が考えられます。対策として、反応中はマイクロプレートに専用のカバーをつけることで、液体の蒸発を防ぐことができます。
マイクロプレートの底が汚れている
マイクロプレートの底が汚れており、吸光度測定に影響を与えた可能性が考えられます。マイクロプレートの底は反応や洗浄の過程で汚れることがあります。その汚れにより同一サンプル間の吸光度に差が生じる可能性があります。対策として、吸光度測定の前にプレートの底面をキムワイプ等できれいに拭くことで改善する可能性があります。
発色するのに時間がかかる
- 酵素反応の条件が不適切
- 基質溶液が古い
酵素反応の条件が不適切
酵素には反応が効率よく進む最適温度があります。そのため、酵素反応をさせる環境や反応溶液の温度が不適切な場合、発色反応が十分に行われません。対策として、発色反応を行う温度を酵素の最適温度に保つことで改善する可能性があります。また、基質溶液を冷蔵または、冷凍で保管していた場合、室温に戻してから使用用してください。
他には、基質溶液の反応時間が短いことが考えられます。対策として、反応時間を長くすることで改善する可能性があります。
基質溶液が古い
試薬を何度も凍結融解すると、試薬が劣化して発色反応が進まなくなることがあります。対策として、基質溶液を新しく調製する事で改善する可能性があります。
発色がうまくいかない(発色しない)
- サンプル中の目的タンパク質量が少ない
- マイクロプレートの固相化が不均一
- 基質溶液が古い
- 酵素反応を阻害する物質の混入
サンプル中の目的タンパク質量が少ない
目的タンパク質の発現量が少ない、または抽出できていない可能性があります。対策として、サンプル中のタンパク質発現量が少ない場合、サンプル数を増やすことで改善する可能性があります。また、サンプル細胞の溶解に用いるLysis bufferによって目的のタンパク質が可溶化されていない可能性が考えられます。その場合、サンプル細胞の溶解条件を変えることで改善できる可能性があります。
マイクロプレートの固相化が不均一
固相化が不均一にる原因として、固相化するタンパク質や抗体に対して適切なコーティングのマイクロプレートを使用していない可能性があります。対策として、実験系に適切なコーティングのマイクロプレートに変更することで改善する可能性があります。
基質溶液が古い
基質溶液が古く、発色反応が進んでいない可能性があります。試薬を何度も凍結融解すると、試薬が劣化して発色反応が進まなくなることがあります。対策として、基質溶液を新しく調製する事で改善する可能性があります。
酵素反応を阻害する物質の混入
西洋わさびペルオキシダーゼによる発色反応はアジ化ナトリウムにより阻害されます。アジ化ナトリウムは抗体製品の防腐剤として添加されている場合があります。対策として、アジ化ナトリウムを含まない抗体製品を使用することで改善する可能性があります。
検量線がうまく引けない
- 標準物質の調製の不備
- マイクロプレートの固相化が不均一
- コンタミネーションの可能性
- 反応に用いる試薬、溶液が不均一
標準物質の調製の不備
検量線の作成に用いる目的タンパク質の標準物質の調製に不備がある可能性があります。標準物質を溶解して検量線用のサンプルを作成します。この時、標準物質の計量が正確でない、溶解する液量が正確でない場合、検量線が正確に引けない原因になります。対策として、検量線作成に用いる標準物質や溶解液量の標量を正確に行うことで改善します。
マイクロプレートの固相化が不均一
マイクロプレートへの目的タンパク質の固相化や抗体の固定が不均一なため、検量線のデータ間のばらつきが生じた可能性があります。固相化が不均一になる原因として、固相化するタンパク質や抗体に対して適切なコーティングのマイクロプレートを使用していない可能性があります。対策として、実験系に適切なコーティングのマイクロプレートに変更することで改善する可能性があります。
コンタミネーションの可能性
マイクロプレートの検量線用の標準物質を加えた場所に、誤ってサンプルや他の濃度の標準物質の溶液が入り込んだことによるコンタミネーションの可能性があります。例えば、ピペット操作時のミスやピペットのチップの交換を忘れたことなどの理由が考えられます。対策として、コンタミネーションが起こらないよう、ピペット操作は正確に注意深く行いましょう。また、ピペットのチップはサンプルごとに必ず交換しましょう。
反応に用いる試薬、溶液が不均一
反応に用いる試薬、溶液が不均一なため、マイクロプレートのウェル毎に試薬濃度が変わったため生じた可能性があります。対策として、試薬やサンプルの濃度が不均一にならないよう、プレートに滴下する前に十分に混和することで改善します。
まとめ
今回の記事ではELISAについて紹介しました。
組織や細胞から抽出したタンパク質や細胞から細胞培養液中などの試料溶液中に分泌された目的タンパク質の検出・定量
抗体により目的タンパク質を特異的に選択し、酵素による発色を利用して、目的タンパク質を検出、定量します。
4種類のELISA法の工程
- タンパク質を直接マイクロプレートに固相化
- 酵素標識された抗体の結合
- 酵素による発色と吸光度による検出
- 検量線の作成と定量
- タンパク質を直接マイクロプレートに固相化
- 一次抗体と二次抗体の結合
- 酵素による発色と吸光度による検出
- 検量線の作成と定量
- 抗体を介してタンパク質をマイクロプレートに固定
- 酵素標識された抗体の結合
- 酵素による発色と吸光度による検出
- 検量線の作成と定量
- 抗体を介してタンパク質をマイクロプレートに固定
- 酵素標識したタンパク質の結合
- 酵素による発色と吸光度による検出
- 検量線の作成と定量
ELISA法のメリットとデメリット
ELISA法の失敗8選
- ネガティブコントロールで発色を認める
- バックグラウンドが高い
- 全体的に吸光度が小さい
- 吸光度が大きい
- データのばらつきが大きい
- 発色するのに時間がかかる
- 発色がうまくいかない(発色しない)
- 検量線がうまく引けない
タンパク質を検出・定量する方法はELISA法以外にもあります。他の方法については、下記記事にて紹介しています。