そんなあなたのために、博士号を持ち、国内外で分子生物学の研究を続けてきた私が、研究の現場でよく使われる手法を厳選して解説します。
- 特定のタンパク質の定量には、抗原抗体反応を利用する
- 様々なサンプルに汎用性が高いのはウエスタンブロッティング
- 液体サンプルを調べるならELISA
- ウイルス感染の有無を調べるならイムノクロマト法
- サンプルの形態、構造を保持したまま調べるなら免疫染色
- サンプル中のタンパク質を網羅的に調べるならプロテオーム解析
この記事を読めば、発現したタンパク質を解析する手法の原理と大まかな実験の流れがわります。課題で使えるだけでなく、研究室に配属された学生さんは、実験の流れをイメージして自分の実験に取り組みましょう!
発現したタンパク質の解析で細胞の機能的な状態がわかる
発現したタンパク質を解析すると、細胞内でそのタンパク質をコードしている遺伝子が実際に機能しているかどうかがわかります。遺伝子が働くためには、その遺伝子が転写されてmRNAが発現し、そのmRNAがタンパク質へと翻訳される必要があるからです。また、タンパク質への翻訳後も、修飾や分解などで機能が制御されています。
皆さんの中には、わざわざタンパク質を定量しなくても、mRNAの発現量を定量すれば遺伝子が働いていることがわかるんじゃないの?と思われる方もいるかもしれません。たしかに、「ある遺伝子のmRNA量の変化」=「その遺伝子がコードしているタンパク質の機能的な変化」である場合もあります。しかしタンパク質の中には、翻訳された直後に分解されて機能が抑制されているもの、翻訳されても働く場所とは違う場所に隔離されているもの、リン酸化などの修飾を受けてはじめて機能するものなどがあります。そのような場合、mRNAの発現量を調べるだけではその遺伝子が機能しているかどうかはわかりません。そのため、以下のような手法でタンパク質を解析することが重要なのです。
特定のタンパク質を解析する手法4選
特定のタンパク質を解析するためには、抗原と抗体の特異的な反応である抗原抗体反応を利用した実験手法が用いられます。ここで言う抗原とは、自分が解析したい目的のタンパク質です。その目的タンパク質に特異的に結合する抗体を利用します。
ウェスタンブロッティング

発現したタンパク質の定量方法として最も一般的なのがウェスタンブロッティング(ウェスタンブロット、Western blotting、Western blot、WB)です。培養した細胞や自分が興味のある組織中に、目的のタンパク質がどのくらい発現しているのかを定量したい場合に用いられます。
まず細胞/組織中のタンパク質をポリアクリルアミドゲル電気泳動(SDS-PAGE)によって分子量ごとに分離し、PVDFメンブレンやニトロセルロースメンブレンに転写します。次に、タンパク質が転写されたメンブレンにブロッキング処理をします。この処理によって、抗体が目的タンパク質以外に結合してしまうことを防ぎます。
次に、抗体反応です。まずはメンブレンを目的のタンパク質を認識する抗体(一次抗体)と反応させます。その後、一次抗体を認識する抗体(二次抗体)と反応させます。この二次抗体は、西洋わさびペルオキシダーゼ(HRP)やアルカリフォスファターゼ(AP)などの酵素で標識されていて、専用の試薬と反応させると化学発光を起こします。この発光した光をX線フィルムやCCDイメージャーを用いて検出します。サンプル中に含まれる目的タンパク質の量が多いほど強く発光するため、シグナル強度で特定のタンパク質を定量することができます。

ELISA
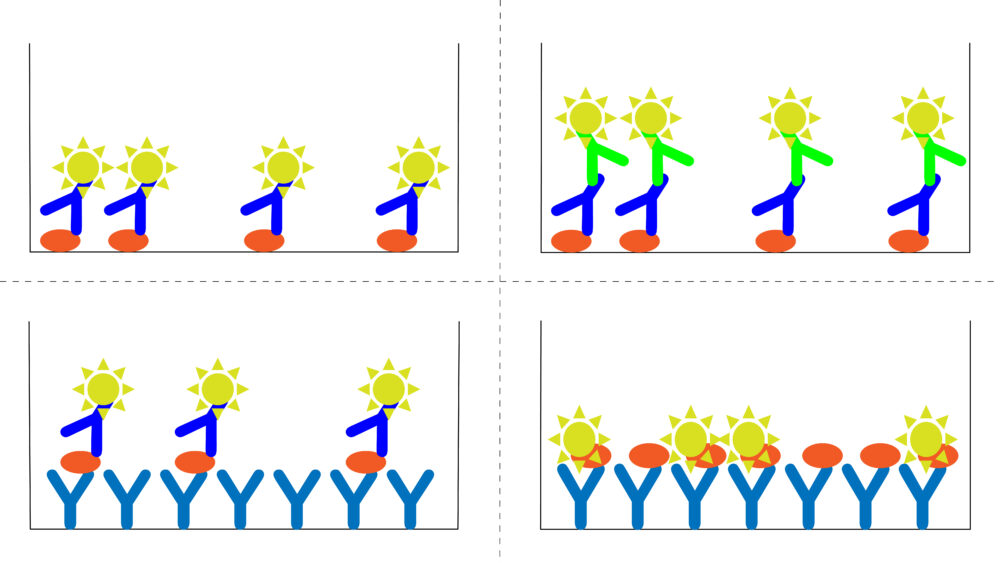

血清や血漿、細胞培養培地などの、液体サンプル中に含まれる分泌性タンパク質やホルモンを定量する場合はELISA(Enzyme-Linked Immuno Sorbent Assay: イライザ、エライザ)が広く用いられます。ELISAには、直接法、間接法、サンドイッチ法、競合法などがありますが、最もよく使われるのがサンドイッチ法です。
ここではサンドイッチ法を解説します。この方法は、抗原(目的タンパク質)を固相化抗体と酵素標識検出抗体で挟み込んで検出します。抗体で挟むためサンドイッチ法と呼ばれます。
まず、ELISA用96ウェルプレートに目的の抗原を認識する抗体(固相化抗体、キャプチャー抗体)を吸着させる固相化を行います。次に、ブロッキングバッファーを加えて、固相化抗体が目的の抗原以外に結合してしまうのを防ぎます。
次に、液体サンプルをウェルに加えて、固相化抗体と抗原を結合させます。そして、西洋わさびペルオキシダーゼ(HRP)やアルカリフォスファターゼ(AP)などの酵素で標識された抗体(検出抗体)を加えて反応させます。この検出抗体が、すでに固相化抗体と結合している抗原に結合します。
ここでのポイントは、固相化抗体と検出抗体は、同じ抗原の別の場所(エピトープ)を認識する抗体である必要があるというところです。そうでないと、検出抗体が結合する部位が固相化抗体に占領されて結合できなくなってしまうためです。
最後に、検出抗体に標識してある酵素の基質溶液をウェルに加えて反応させます。抗原に結合している検出抗体の量に応じて発色するため、プレートリーダーで吸光度を測定することで定量することができます。



イムノクロマト法

新型コロナウイルスやインフルエンザウイルスの抗原検査キット、妊娠検査キットなどで用いられているのがイムノクロマト法(イムノクロマトグラフィ)です。この方法は、サンプル中に目的の抗原(ウイルスタンパク質など)があるかないかを調べる定性的な手法で定量性は低いです。臨床研究や病院で用いられることが多く、基礎研究の分野で用いられることは多くありません。


イムノクロマト法は、セルロース膜上を検体サンプル(血液、鼻水、尿など)がゆっくり流れる性質(毛細管現象)を利用した手法です。まず、検体を滴下するセルロース膜(サンプルパッド)上には、目的の抗原を認識する抗体が吸着(固相化)されています。この抗体は、金コロイドなどで標識されており、抗原特異的標識抗体と呼ばれます。検体が滴下されると、抗原と結合した標識抗体も、結合していない標識抗体も一緒に進行方向へ流れていきます。
検体の進行方向にあるテストライン(T)上には、目的の抗原を認識する抗体(抗原特異的固定化抗体)が吸着(固相化)されています。ここで使われている抗体は、抗原特異的標識抗体とは別の場所(エピトープ)を認識する抗体である必要があります。検体中に目的の抗原(ウイルスなど)が含まれている場合、すでに標識抗体と結合した抗原がここに結合するため、このテストラインにバンドが現れます。
テストラインよりもさらに進行した先にあるチェック(コントロール)ライン(C)上には、標識抗体を認識する抗体(標識抗体特異的抗体)が固相化されています。ここでは、サンプルパッド上に吸着されていた標識抗体が結合するため、陽性・陰性に関わらずバンドが現れます。もしチェックライン上にバンドが現れない場合、その検査は無効となります。
テストラインとチェックライン両方にバンドが現れた場合は陽性、チェックラインのみにバンドが現れた場合は陰性となります。



免疫染色


腫瘍やその周辺組織で発現しているタンパク質などを形態学的に解析したい場合、免疫染色が用いられます。現状、細胞や組織中におけるタンパク質発現の空間(位置)情報を調べるためには、この手法がゴールドスタンダードです。免疫染色では抗体を用いて、生体内の組織構成や細胞の特徴、構造を維持したまま目的タンパク質の発現を定量することが可能です。



一般的に、免疫染色で組織を解析する場合は免疫組織化学染色(IHC: immunohistochemistry)と呼ばれ、細胞を解析する場合は免疫細胞化学染色(ICC: immunocytochemistry)と呼ばれます。両者とも実験手法は基本的に同じですが、IHCでは観察したいサンプルの切片(パラフィン切片や凍結切片)を作成するという点が異なります。
ここでは、最も一般的なパラフィン切片を用いたIHCの方法を解説します。まず生体から摘出した組織を固定します。固定液には、ホルムアルデヒドやグルタルアルデヒドなどが用いられます。この処理によってサンプルの形態が保持されます。
次に、パラフィン包埋切片を作成します(この処理はICCでは行いません)。そしてパラフィン切片の場合、熱処理などによって抗原賦活化を行います。この処理によって、抗原部位が露出し、目的のタンパク質に抗体が結合しやすくなります。
次に、ブロッキング処理によって、抗体が目的タンパク質以外に結合してしまうのを防ぎます。ブロッキング剤には、使用する二次抗体の宿主動物種の血清を用います。
次に、抗体反応です。まずはサンプルを目的のタンパク質を認識する抗体(一次抗体)と反応させます。その後、一次抗体を認識する抗体(二次抗体)と反応させます。この二次抗体は、蛍光で標識されたものや酵素で標識されたものがありますが、蛍光標識のものが最も広く使われています。最後に、サンプルを蛍光顕微鏡で観察し、写真撮影などを行います。サンプルの蛍光強度を数値化することで定量することができます。



発現しているタンパク質を網羅的に解析する手法
プロテオーム解析
細胞や組織中で機能しているタンパク質を網羅的に定量解析する手法がプロテオーム解析です。この手法では、タンパク質同士の相互作用を含め、生体内で起きていることをまとめて調べることが可能です。
プロテオーム解析には目的に応じて様々な手法がありますが、大きく2つの手法に分けられます。ひとつは、細胞/組織から抽出したタンパク質を二次元電気泳動で分離・精製し、質量分析法で解析する手法です。もうひとつは、タンパク質抽出後すぐにプロテアーゼ(タンパク質分解酵素)で分解し、短いペプチドの混合物とした後に質量分析法で解析する手法です。実験手順が比較的簡便なため、後者の方が広く用いられています。
質量分析計によってデータを取得後、その情報をデータベースと照合してタンパク質を同定します。それによって、サンプル中にどのタンパク質がどれくらい含まれていたのかを網羅的かつ定量的に調べることができます。



まとめ
この記事では、発現したタンパク質の解析方法の全体像を解説しました。
- 特定のタンパク質の定量には、抗原抗体反応を利用する
- 様々なサンプルに汎用性が高いのはウエスタンブロッティング
- 液体サンプルを調べるならELISA
- ウイルス感染の有無を調べるならイムノクロマト法
- サンプルの形態、構造を保持したまま調べるなら免疫染色
- サンプル中のタンパク質を網羅的に調べるならプロテオーム解析
各手法についての解説は、下記ページにて行っています。