皆さんはウェスタンブロッティング(Western blotting)、ウェスタンブロット(Western blot)について説明できますか?また、実際にウェスタンブロッティングでタンパク質を検出、定量することができますか?
今回はこのような悩みを持つ学生の方に向けて、ウェスタンブロッティングでの検出・定量の原理、実際の方法、メリットとデメリット、失敗とトラブルシューティングをまとめました。この記事を読んで、講義で学んだウェスタンブロッティングを復習し実際に目的のタンパク質を定量できることを目指しましょう。
WBの目的はタンパク質の検出、定量
ウェスタンブロッティングの目的はタンパク質発現の検出と定量です。細胞内で遺伝子情報が実際に発現する際、DNAから転写されたmRNAをもとに、タンパク質が翻訳(合成)されます。ウェスタンブロッティングではこの翻訳されたタンパク質を検出・定量することを目的にしています。
WBは抗体を用いてタンパク質を検出、定量する
ウェスタンブロッティングの原理は抗体を用いて、目的のタンパク質を検出、定量します。ウェスタンブロッティングはSDS-PAGEでサイズごとに分離したタンパク質を電圧をかけてゲルからメンブレンに転写します。そして、メンブレンに一次抗体を反応させ、酵素などで標識した二次抗体を反応させます。最後に、酵素による化学発光などを用いて特定のタンパク質を検出し、バンドの濃淡により目的のタンパク質量を定量します。
WBの5つの工程
ウェスタンブロッティングは以下の5つの工程で行います。
- SDS-PAGE
- メンブレンへの転写
- ブロッティング
- 抗体反応
- 検出
上で示した5つの工程のうち、“1. SDS-PAGE”はこちらの記事で解説しています。

2. メンブレンへの転写
SDS-PAGEでサイズごとに分離したタンパク質を、ゲルからメンブレンに転写します。
2種類のメンブレンとそのメリット、デメリット
ウェスタンブロッティングではニトロセルロースメンブレンとPVDFメンブレンの2種類がよく使われます。
ニトロセルロースメンブレン
PVDFメンブレン
2種類の転写方法とそのメリット、デメリット
転写はSDS-PAGEで分離されたタンパク質が、SDS化により負の電荷を持つことを利用します。転写方法は、セミドライ式とウェット式の2種類の方法があります。
セミドライ式


セミドライ式では、転写バッファーに浸したろ紙の間にゲルとメンブレンをセットして転写を行います。
ウエット式(タンク式)
ウエット式では、ゲルおよびメンブレンをタンク内の転写バッファーに沈めて転写を行います。
3. ブロッキング
ブロッキングはメンブレンへの抗体の非特異的な結合を防ぐために行います。ブロッキングにはウシ血清アルブミンやスキムミルクなどのタンパク質溶液を用います。メンブレン膜をこれらの溶液に一晩浸し、メンブレン膜のタンパク質が結合していない部分をブロッキング剤でコーティングします。
4. 抗体反応


目的のタンパク質に抗体を結合させて、検出の準備をします。はじめに、目的のタンパク質に対する一次抗体を結合させます。一次抗体は目的のタンパク質の特定部位に対して特異的に結合するよう設計することが可能です。また、リン酸化などの特定の修飾されたタンパク質のみ検出できるように設計することも可能です。
次に、一次抗体を認識する二次抗体を結合させます。主に、一次抗体を作製した動物の抗体に対する抗体を用います。また、二次抗体は検出に用いるための酵素や蛍光色素、放射性同位体で標識されています。
5. 検出
二次抗体の標識を用いて、目的のタンパク質を検出します。一般的な検出方法には、アルカリホスファターゼや西洋ワサビペルオキシダーゼ等の酵素による化学発光があります。他には、蛍光色素や32Pなどの放射性同位体を用いた検出方法があります。
得られた目的のタンパク質のバンドの濃淡からタンパク質の検出や定量を行います。バンドの濃さは、一定の範囲内でタンパク質の量に比例します。そのため、あらかじめ濃度が既知のタンパク質を用いて検量線を引くことでサンプルのタンパク質を定量できます。
WBのメリットとデメリット
特定のタンパク質を検出、定量する方法には、ウェスタンブロッティング以外にもいくつかの方法があります。他の方法についてはこちらの記事をご確認ください。ここでは、これら他の方法と比較しての、ウェスタンブロッティングのメリット・デメリットを解説します。



WBのメリット3選
目的タンパク質の分子量がわかる
ウェスタンブロッティングではタンパク質の分子量がわかります。ウェスタンブロッティングでは、SDS-PAGEでタンパク質を分子量ごとに分離します。その際に、分子量ラダーマーカーを同時に流すことで、目的とするタンパク質のおおよその分子量がわかります。
翻訳後修飾されたタンパク質の検出も可能
ウェスタンブロッティングでは、リン酸化やメチル化など、翻訳後修飾されたタンパク質も検出できます。ウェスタンブロッティングに用いる一次抗体には、リン酸化やメチル化など特定の修飾がされたタンパク質にのみ反応するものもあるためです。タンパク質には、翻訳後修飾で活性が調節されているものもあります。修飾されたタンパク質を特異的に検出することで、そのタンパク質の活性状態などを調べることが可能です。
リプロービングが可能
ウェスタンブロッティングに一度用いたメンブレンに抗体を反応させ直すことで、別のタンパク質を検出、定量することができます。メンブレンに転写したタンパク質は比較的安定で、長期的に保管することが可能です。そのため、測定のために一度結合させた抗体を取り除き(ストリッピング)、改めて別の抗体を反応させる(リプロービング)ことで、別のタンパク質を検出、定量できます。
WBのデメリット3選
測定に時間がかかる
ウェスタンブロッティングはSDS-PAGE後から検出まで数日かかることがあります。SDS-PAGEに1時間強、ゲルからメンブレンへの転写に数時間、ブロッキングに一晩、抗体反応に一晩かかることがあります。
微量な差を検出しにくい
ウェスタンブロッティングの定量は、バンドの濃淡を比較することで行います。しかしながら、タンパク質量の差が小さい場合、その差がバンドの濃淡では検出できないことがあります。
測定に必要なタンパク質量が多い
ウェスタンブロッティングでは総細胞または、組織溶解液では最低でも10〜50 µg、精製されたタンパク質であれば0.1〜1.0 µgのタンパク質サンプルが必要になります。タンパク質量が少ないとバンドが薄くなり、検出や定量が困難になります。そのため、実験には充分な量の目的タンパク質の準備が必要です。



WBの失敗5選とそのトラブルシューティング
- 非特異的なバンドが出現する
- バックグラウンドが高い
- 目的のタンパク質のバンドが薄い
- 目的のタンパク質のバンドが濃い
- バンドの白抜け
それぞれの失敗の原因と対策を紹介します。
非特異的なバンドが出現する
非特異的なバンドの出現については以下の原因が考えられます。
- ブロッキング条件が不適切
- 一次抗体の濃度が高い
- シグナル検出力が強すぎる
ブロッキング条件が不適切
不適切なブロッキングで、抗体が目的エピトープ以外に結合するため起こります。ブロッキング剤の種類を変えることで改善する場合があります。
一次抗体の濃度が高い
抗体反応の時、抗体(特に、一次抗体)の濃度が高く、目的以外のタンパク質に抗体が非特異的に結合した可能性が考えられます。対策は、反応に用いる抗体の濃度を低くすることです。
シグナル検出力が強すぎる
化学発光や蛍光を検出する検出器の感度が高すぎる可能性があります。対策は、二次抗体の濃度や化学反応に用いる反応液の濃度を減らすことです。また、目的のタンパク質のバンドも薄くなる可能性もありますが、検出器の感度を下げることでも改善できます。
バックグラウンドが高い・部分的に非特異的なシグナルが出る
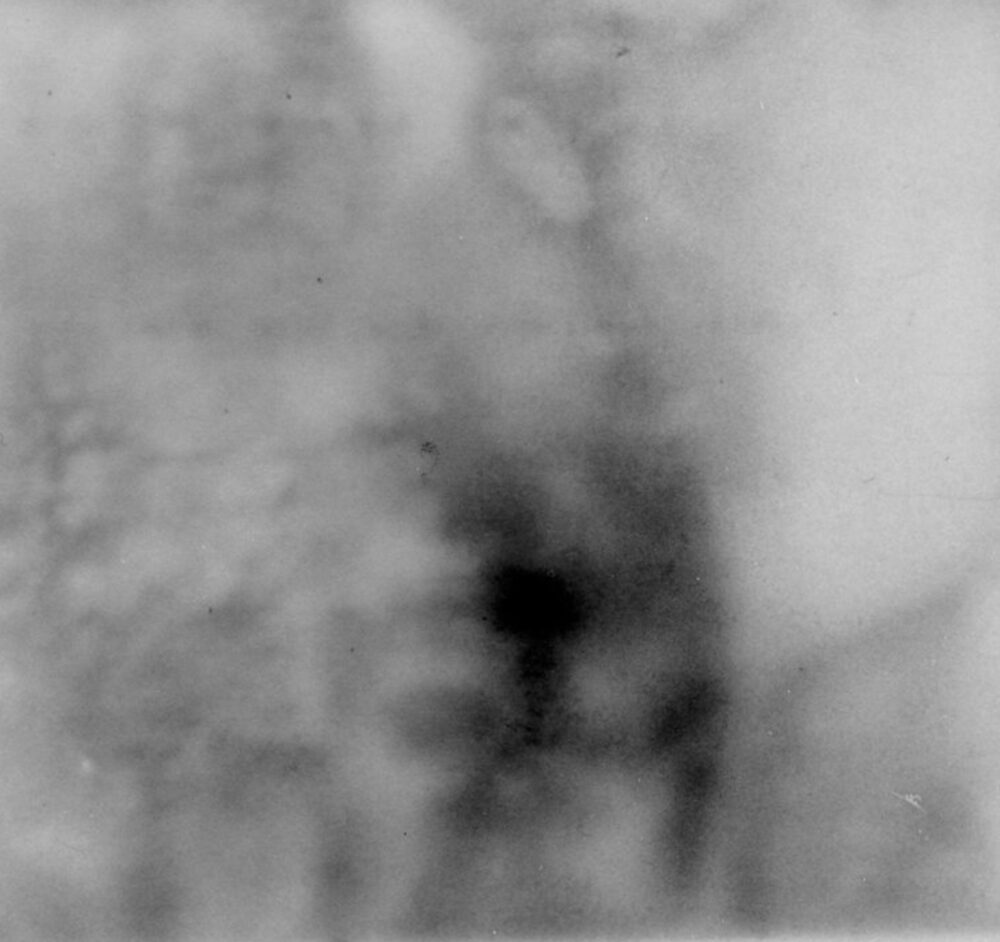

バックグラウンドが高い原因には以下が考えられます。
- 器具や装置、試薬の汚れによるコンタミネーション
- ブロッキングが不十分
- 一次抗体の濃度が高い
- メンブレンの洗浄が不十分
- シグナル検出力が強すぎる
器具や装置、試薬の汚れによるコンタミネーション
装置や器具に残った汚れ、試薬が古くなっていることが原因で生じたコンタミネーションが原因の可能性があります。装置や器具を洗浄し、実験操作は手袋をつけて行いましょう。また、試薬が古い場合は新しく作り直すことで改善できます。
ブロッキングが不十分
ブロッキングが不十分で、メンブレンに直接、抗体が非特異的に結合するため起こります。対策として、ブロッキングに用いるタンパク質溶液の濃度を上げる、またはブロッキング剤の種類を変えることで改善する場合があります。また、ブロッキングにかける時間を増やすことで改善できる可能性があります。
一次抗体の濃度が高い
抗体反応の時、抗体(特に、一次抗体)の濃度が高く、メンブレンに抗体が非特異的に結合している可能性が考えられます。対策は、反応に用いる抗体の濃度を低くすることです。
メンブレンの洗浄が不十分
抗体反応の後のメンブレンの洗浄が不十分で、非特異的に結合した抗体の除去ができていない可能性があります。その場合、洗浄に使用するバッファーの量や洗浄回数・時間を増やすことで改善します。
シグナル検出力が強すぎる
化学発光や蛍光を検出する検出器の感度が高すぎる可能性があります。対策は、二次抗体の濃度や化学反応に用いる反応液の濃度を減らすことです。また、目的のタンパク質のバンドも薄くなる可能性もありますが、検出器の感度を下げることでも改善できます。
目的のタンパク質のバンドが薄い
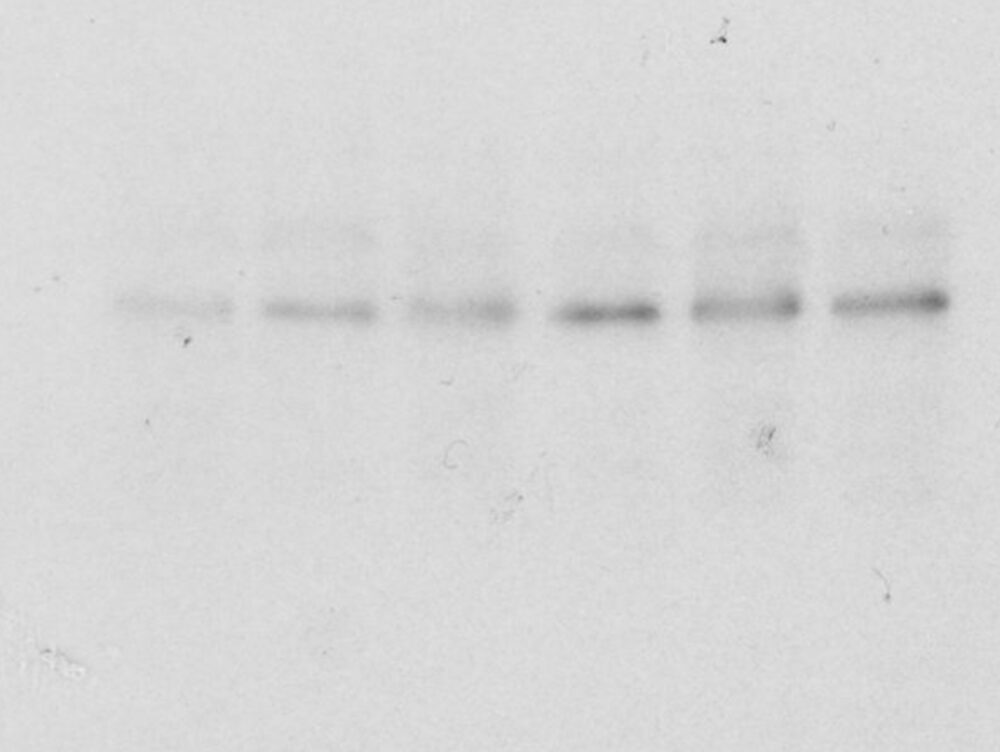

シグナルが弱い原因には以下が考えられます。
- サンプルのタンパク質の量が少ない
- 転写が十分にできていない
- 抗体の結合が不十分
- 化学発光シグナルが弱い
サンプルのタンパク質の量が少ない
SDS-PAGEで泳動するタンパク質の量が少ない可能性があります。目的タンパク質の発現量が少ないと考えられる場合、タンパク質の抽出量を増やす、泳動するタンパク質量を増やすことでことで改善します。また、サンプル細胞の溶解に用いるLysis bufferによって目的のタンパク質が可溶化されていない可能性が考えられます。その場合、サンプル細胞の溶解条件を変えることで改善できる可能性があります。
転写が十分にできていない
ゲルからメンブレンへの転写が十分にできていない可能性があります。メンブレンとゲルの間の隙間は転写が不十分な原因になります。ゲルにメンブレンを乗せたあとに、ローラーでゲルとメンブレンを密着させましょう。また、転写の時間を長くする、かける電圧を強くすることでも改善できます。
また、低分子タンパク質の場合、転写の時間が長い、もしくは電圧が高い場合、タンパク質がメンブレンを通過することがあります。この場合、転写バッファーにメタノールを20%になるように加える、メンブレンの種類をタンパク質結合力の強いPVDFメンブレンに変更することでメンブレンとタンパク質の結合を強くすることができます。他には、転写時間を短くする、または、ポアサイズ(孔の大きさ)が小さいメンブレンを使うことで、目的のタンパク質がメンブレンを通過することを防止できます。
抗体の結合が不十分
目的のタンパク質と一次抗体との結合が不十分なため、シグナルが弱い可能性があります。タンパク質側の原因として、タンパク質の抽出、電気泳動、転写の過程で過剰な熱が加わることで抗原性が失われた可能性があります。対策として、タンパク質サンプルを冷やしながら取り扱う、転写の際にウエット式を用いることが挙げられます。
また、抗体側の原因として、抗体反応に用いる一次抗体の量が不足している可能性があります。その場合は、一次抗体の量を増やすことで改善します。
化学発光シグナルが弱い
化学発光により目的のタンパク質を検出する場合、化学発光シグナルが弱いためシグナルが弱い可能性があります。検出試薬の量を増やす、または反応時間を長くすることで改善します。もし使っている検出試薬が古い場合は、新しいものに交換しましょう。
また、検出時間が短いことも考えられます。その場合、露光時間を長くすることで改善します。
目的のタンパク質のバンドが濃い
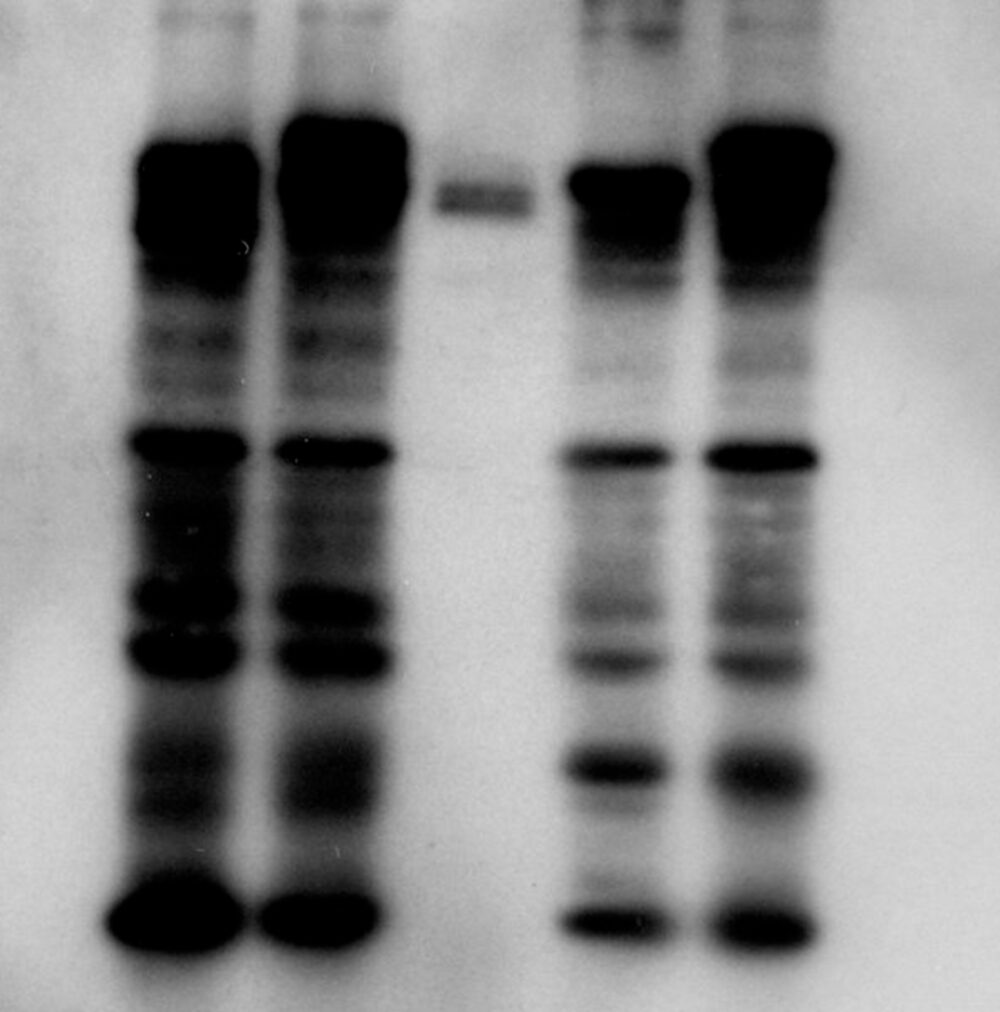

バンドが濃すぎる原因には以下が考えられます。
- 電気泳動に流すタンパク質の量が多い
- 一次抗体の濃度が高い
- シグナル検出力が強すぎる
電気泳動に流すタンパク質の量が多い
SDS-PAGEで泳動するタンパク質の量が多い可能性があります。目的タンパク質の発現量が多いと考えられる場合、抽出したタンパク質を希釈する、泳動するタンパク質量を減らすことでことで改善します。
一次抗体の濃度が高い
抗体反応の時、抗体(特に、一次抗体)の濃度が高く、目的のタンパク質に抗体が必要以上に結合している可能性が考えられます。対策は、反応に用いる抗体の濃度を低くすることです。
シグナル検出力が強すぎる
化学発光や蛍光を検出する検出器の感度が高すぎる可能性があります。対策は、二次抗体の濃度や化学反応に用いる反応液の濃度を減らすことです。また、検出器の感度を下げることでも改善できます。
バンドの白抜け
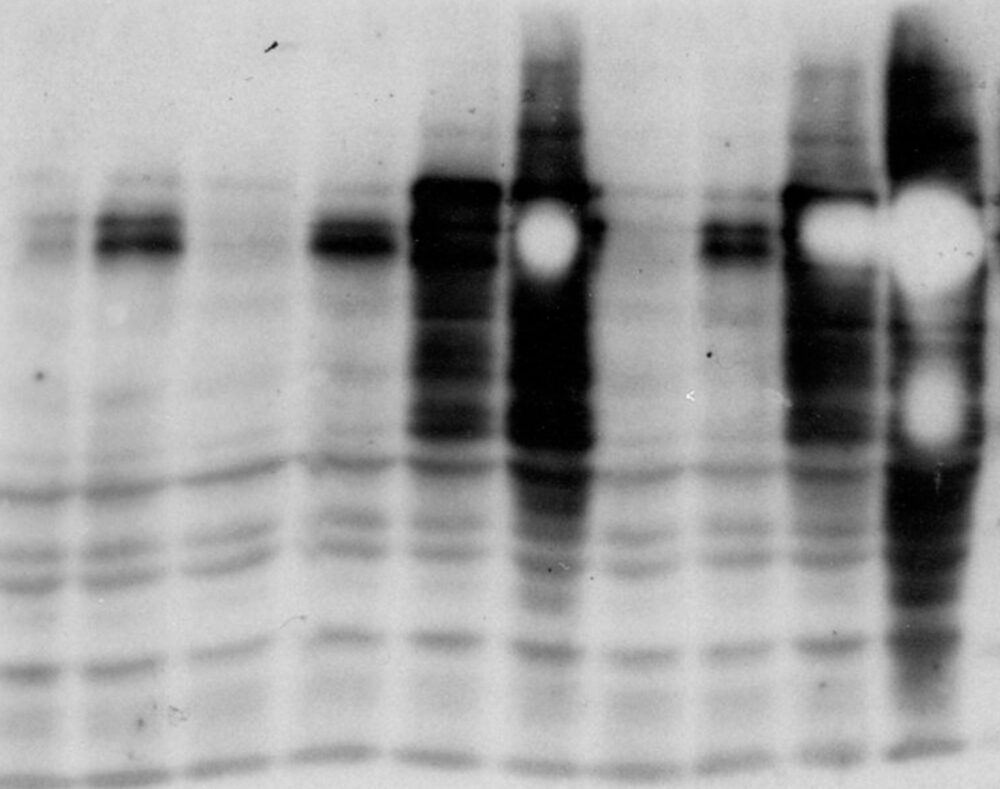

バンドが白抜けするのは、その部分の標識抗体量が多すぎるために発光基質が急速に反応して消費されたためです。その原因は以下のことが考えられます。
- 電気泳動に流すタンパク質の量が多い
- 抗体の濃度が高い
電気泳動に流すタンパク質の量が多い
SDS-PAGEで泳動するタンパク質の量が多い可能性があります。実際に、白抜けが生じる場合、目的のタンパク質のバンドが太くなることが多いです。目的タンパク質の発現量が多いと考えられる場合、抽出したタンパク質を希釈する、泳動するタンパク質量を減らすことでことで改善します。
抗体の濃度が高い
抗体反応の時、一次抗体と二次抗体のどちらかまたは両方の濃度が高く、目的のタンパク質に抗体が必要以上に結合している可能性が考えられます。対策は、反応に用いる抗体の濃度を低くすることです。
まとめ
今回の記事ではウェスタンブロッティング(WB)について紹介しました。
組織や細胞でのタンパク質発現の検出と定量
SDS-PAGEでサイズごとに分離したタンパク質をゲルからメンブレンに転写します。メンブレンに抗体を反応させ、バンドの濃淡により目的のタンパク質量を定量します。
- SDS-PAGE
- メンブレンへの転写
- ブロッティング
- 抗体反応
- 検出
ウェスタンブロッティングのメリットとデメリット
ウェスタンブロッティングの失敗5選
- 非特異的なバンドが出現する
- バックグラウンドが高い・部分的に非特異的なシグナルが出る
- 目的のタンパク質のバンドが薄い
- 目的のタンパク質のバンドが濃い
- バンドの白抜け
タンパク質を検出・定量する方法はウェスタンブロッティング以外にもあります。他の方法については、下記記事にて紹介しています。