Phosphorylation of phase-separated p62 bodies by ULK1 activates a redox-independent stress response
Ryo Ikeda, Daisuke Noshiro, Hideaki Morishita, Shuhei Takeda, Shun Kageyama, Yuko Fujioka, Tomoko Funakoshi, Satoko Komatsu-Hirota, Ritsuko Arai, Elen Ryzhii, Manabu Abe, Tomoaki Koga, Hozumi Motohashi, Mitsuyoshi Nakao, Kenji Sakimura, Arata Horii, Satoshi Waguri, Yoshinobu Ichimura, Nobuo N Noda, Masaaki Komatsu
要約
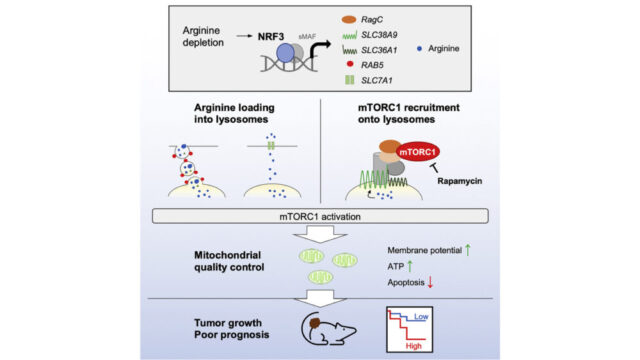
NRF2は通常、酸化ストレス応答を調節する転写因子であり、一般に酸化還元依存的な方法で制御されます。液-液相分離によって形成されるp62-bodyは、Ser349がリン酸化されたp62を含み、酸化還元非依存的なNRF2の活性化に関与します。ただし、p62のリン酸化の調節メカニズムと生理学的な意義は解明されていませんでした。この研究では、p62のリン酸化に関与するキナーゼとしてULK1を同定しています。ULK1はp62-bodyと共局在し、直接p62と相互作用します。ULK1に依存するp62のリン酸化により、KEAP1がp62-body内に保持され、それによりNRF2が活性化されます。p62S351E/+マウスは、ヒトのSer349に相当するSer351がGluで置換されている、リン酸化模倣マウスです。これらのマウスは、そのリン酸欠陥型p62S351A/S351Aとは異なり、NRF2の過活性化と成長遅延を示します。この遅延は、皮膚角化症に伴う食物摂取障害と脱水症状にとるものであり、これは全身的なKeap1ノックアウトマウスでも観察される現象です。この研究結果は、酸化還元非依存的なNRF2活性化経路の生理学的重要性に関与する理解を広げ、このプロセスにおける相分離の役割についての新たな見解をもたらすものです。
はじめに
液-液相分離によるp62-body
液-液相分離型の生体分子凝集体、液滴は、遺伝子発現、タンパク質翻訳、ストレス応答、タンパク質分解など多くの生物学的プロセスで重要な役割を果たしています。これらの液滴は、細胞内の状況に応じてさまざまなRNAやタンパク質を内部に取り込むことで、機能します(Alberti S. (2021) Nat. Rev. Mol. Cell Biol.)。オートファジーは、ストレス顆粒やP-bodyなどのいくつかの細胞質液滴の分解に関与し、この機能低下がこれら液滴の固相への転移を引き起こし、神経変性疾患やがんなどの難治性疾患の発症を引き起こすと考えられています(Woodruff JB. (2018) Trends Biochem. Sci.、Noda NN. (2020) J. Cell Biol.) 。特異な生物学的機能を持ち、オートファジーによって分解される液滴の中で、p62-bodyは、p62とその結合相手であるユビキチン化されたタンパク質の液-液相分離(LLPS)によって形成される液滴です(Sun D. (2018) Cell Res.、Zaffagnini G. (2018) EMBO J.)。p62-bodyは、オートファジーにより分解されることで、細胞内のタンパク質恒常性の調節に関与しており、またkelch-like ECH-associated protein 1(KEAP1)を取り込むことによって、主要なストレス応答メカニズムの調節にも寄与しています(Kirkin V. (2019) Mol. Cell、Faruk MO. (2021b) Cancer Sci.)。
p62のリン酸化から分解までの過程
Unc-51-like kinase 1(ULK1)は、p62のSer407をリン酸化し、p62のユビキチン関連(UBA)ドメインの二量体形成を阻害します(Isogai S. (2011) J. Biol. Chem.、Lim J. (2015) PLoS Genet.)。その後のSer403のTBK1、CK2、TAK1およびULK1によるリン酸化により、ユビキチン化されたタンパク質の結合が可能となります(Matsumoto G. (2011) Mol. Cell、Pilli M. (2012) Immunity、Lim J. (2015) PLoS Genet.、Kehl SR. (2019) EMBO Rep.)。これらのリン酸化イベントは、液-液相分離を促進すると考えられています(Sun D. (2018) Cell Res.、Zaffagnini G. (2018) EMBO J.)。p62-bodyの分解では、FIP200/RB1-inducible coiled-coil protein 1(以下FIP200)、ULK1、ATG13およびATG101から成るULK1プロテインキナーゼ複合体が、FIP200のClawドメインがp62に結合することにより、p62-body上に転移します(Turco E. (2019) Mol. Cell)。また、ULK1プロテインキナーゼ複合体は、FIP200がTAX1BP1と相互作用してp62-bodyに結合することにより、p62の結合パートナーであるNBR1との相互作用を介してp62-bodyにリクルートされます(Turco E. (2021) Nat. Commun.)。その後、ATGタンパク質がp62-bodyの周りに組み立てられます(Kageyama S. (2021) Nat. Commun.)。最終的に、wetting effect(Agudo-Canalejo J (2021) Nature)および隔離膜上のp62へのLC3またはGABARAPの結合により(Kageyama S. (2021) Nat. Commun.)、p62-bodyはオートファゴソームに囲まれ、その後リソソームによる分解が行われます。
KEAP1による2つのNRF2制御経路
KEAP1はnuclear factor erythroid-derived 2-like 2(NRF2)に対するcullin 3ユビキチンリガーゼのアダプタータンパク質であり、NRF2は一連の抗酸化タンパク質や酵素をコードする遺伝子の主要な転写因子です(Yamamoto M. (2018) Physiol. Rev.)。古典的な経路では、KEAP1は酸化修飾によって非活性化され、その後NRF2は酸化還元に依存した調節を介して活性化されます(Yamamoto M. (2018) Physiol. Rev.)。この酸化還元に依存した経路は、酸化還元、代謝、タンパク質ホメオスタシス、および炎症の調節、さらには多くの病態条件に対する細胞保護において重要であることが示されています(Yamamoto M. (2018) Physiol. Rev.、Cuadrado A. (2019) Nat. Rev. Drug. Discov.)。この古典的な経路に加えて、p62の特定の領域がKEAP1と直接相互作用し、KEAP1とNRF2の相互作用を競合的に阻害します(Komatsu M. (2010) Nat. Cell. Biol.)。p62のKEAP1との相互作用領域に位置するSer349のリン酸化は、p62とKEAP1の相互作用を増強し、酸化還元条件に依存せずにNRF2の完全な活性化を引き起こします(Ichimura Y. (2013) Mol. Cell)。ただし、この酸化還元非依存の経路のキナーゼおよび調節機構、およびその生理学的な意義はまだ明確ではありません。
この研究の総括
この研究でははじめて、ULK1がp62のSer349の主要なリン酸化酵素であることを、in vitroおよびin vivoで示しました。ULK1はp62と直接相互作用し、p62のSer349をリン酸化します。ULK1はFIP200に依存しない形で、in vitroおよびin vivoのp62-bodyに局在しています。このリン酸化は、KEAP1のp62-body内への流入には影響を与えませんが、KEAP1の流出を抑制し、KEAP1をp62-body内にとどめ、NRF2を活性化します。Ser349のリン酸化を模倣した変異を持つノックインマウスは、Ser349のリン酸化を阻害する変異を持つマウスとは異なり、持続的なNRF2の活性化を示し、これが角化症を引き起こし、結果的に食道と前胃の閉塞、および栄養不良による重度の成長遅滞を引き起こします。これらの結果から、p62ボディとULK1に依存し、かつ酸化還元に独立したストレス応答の生理学的重要性が示唆されます。
1. ULK1はp62と直接相互作用してリン酸化する
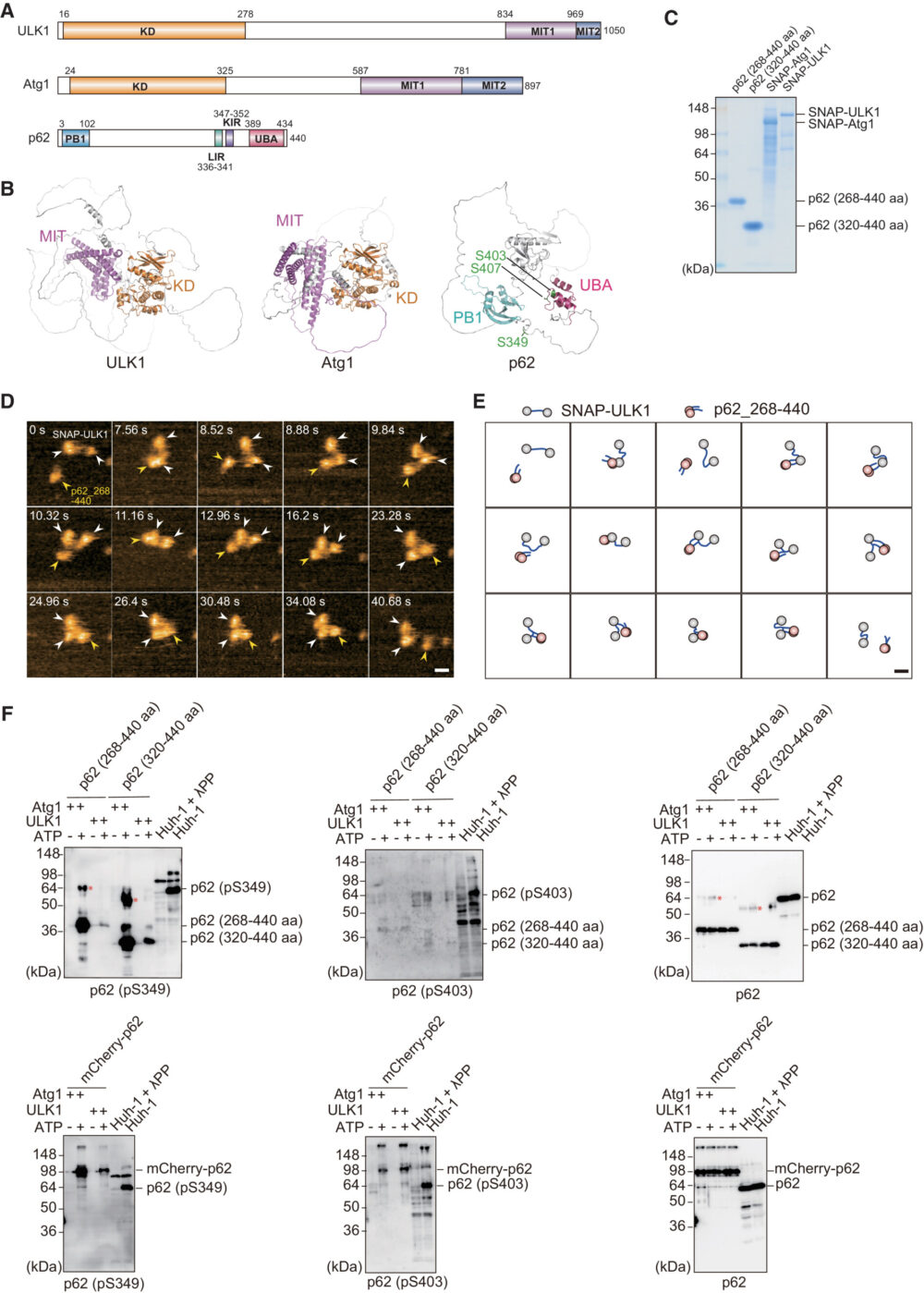
ULK1リン酸化酵素自体がp62-bodyの物理的な特性と生理学的な役割に影響を与えるかどうかを明確にするために、はじめに高速原子間力顕微鏡(high-speed atomic force microscopy; HS-AFM)を使用して、p62とULK1またはその酵母のホモログAtg1との物理的な相互作用を調べました(図1)。ULK1にはN末端にセリンスレオニンキナーゼドメイン(KD)があり、C末端には2つのマイクロチューブ相互作用・輸送(MIT1および2)ドメインがあり、これらすべてが酵母と哺乳類の間で保存されています(図1A)。KDおよびMIT1/2ドメインは、IDR(intrinsically disordered region)によって連結されています(図1B)。p62には、N末端にPB1ドメイン、C末端にUBAドメイン、PB1ドメインとUBAドメインの間のIDRにはLC3相互作用領域(LIR)およびKEAP1相互作用領域(KIR)など、いくつかの相互作用領域が含まれています(図1AおよびB)。筆者らは、p62(268–440 aaおよび320–440 aa)およびSNAPタグ付きULK1およびAtg1を精製しました(図1C)。SNAP-ULK1のHS-AFMは、Atg1と同様に、KDと2つのMITドメインから成る2つの球状ドメインを含み、それらがIDRで互いに連結されていることを示しました(Kodera N. (2021) Nat. Nanotechnol.)。一方、p62(268–440 aa)のHS-AFMは、UBAドメインの二量体化による互いに巻き付いたIDRでハンマーのような構造を形成した、二量体構造で観察されました。SNAP-ULK1もしくはSNAP-Atg1がp62(268–440 aa)と混合されると、p62の二量体は、動的なIDR-IDRおよびIDR-球状ドメイン相互作用を介してSNAP-ULK1およびSNAP-Atg1に直接結合しました(図1DおよびE)。この結果と一致して、ULK1およびAtg1は、直接p62(268–440 aaおよび320–440 aa)をSer349でリン酸化しました(図1F)。Ser403はほとんどリン酸化されませんでしたが(図1F)、mCherryタグ付きの全長p62を使用するとSer403もリン酸化されました(図1F)、これはp62のN末端PB1ドメインがULK1およびAtg1によるSer403の効率的なリン酸化に必要であることを示しています。これらのデータから、ULK1がp62と直接相互作用し、リン酸化することが示唆されます。
2. p62-bodyにおけるULK1の局在
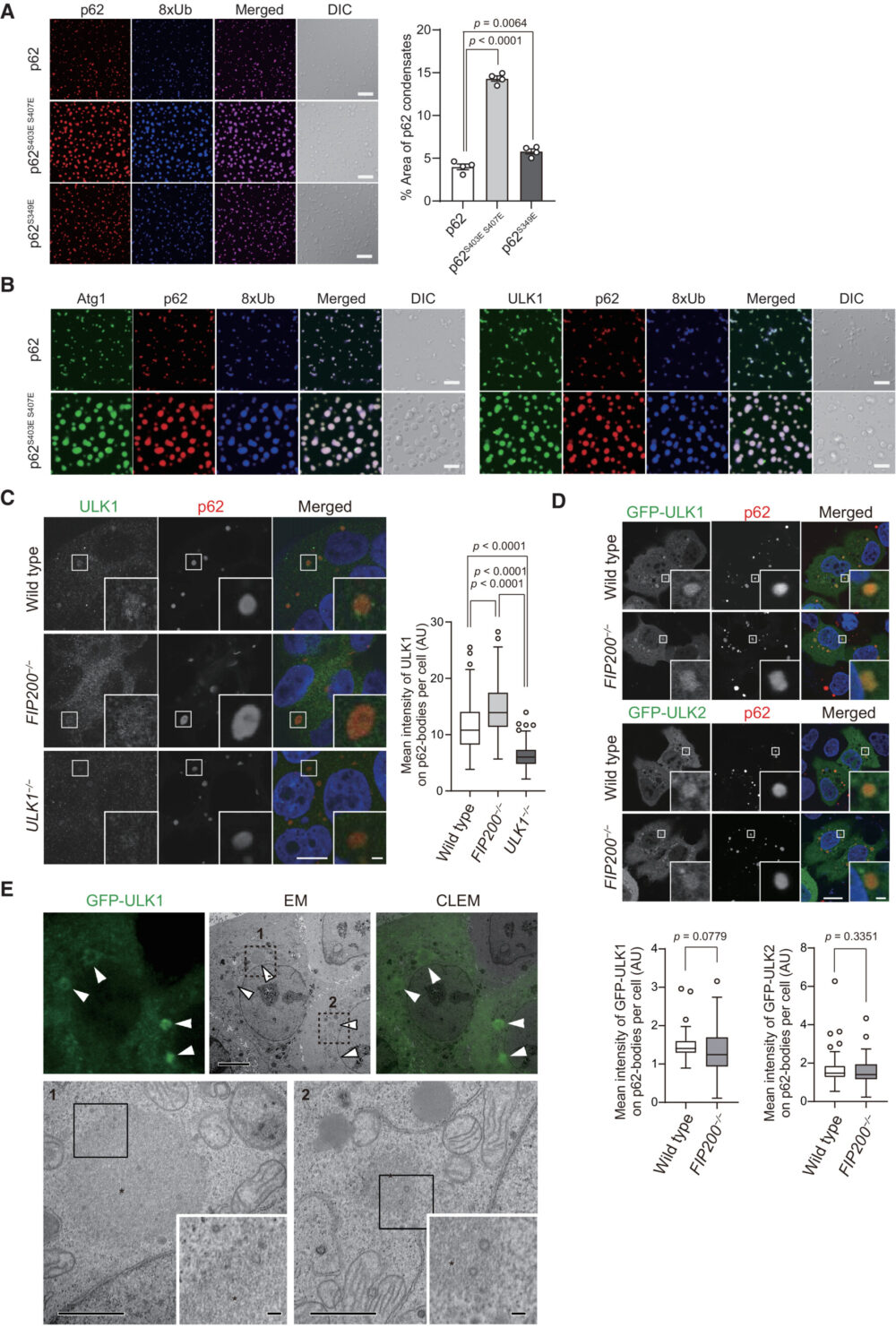
in vitroで、p62はユビキチン化されたタンパク質との相互作用によってLLPSを経て、p62-condensateを形成します(Sun D. (2018) Cell Res.)。筆者らは、SNAP-Atg1とSNAP-ULK1がin vitroでp62-condensateと連関するかどうかを調べました。以前の報告と一致して(Sun D. (2018) Cell Res.、Zaffagnini G. (2018) EMBO J.、Kageyama S. (2021) Nat. Commun.)、mCherry-p62を直鎖状オクタユビキチン(8xUb)と混合すると、condensateが形成されました(図2A)。これらのcondensateのサイズは、p62のユビキチンへの結合親和性を高めることが知られているリン酸化模倣p62変異(S403EおよびS407E)によって、S349Eリン酸化模倣変異よりも大幅に増加しました(図2A)。SNAP-Atg1とSNAP-ULK1は、野生型およびリン酸化模倣p62コンデンセートの両方に、それらすべてを一緒に反応させたときにリクルートされました(図2B)。これらの結果から、Atg1およびULK1の両方が、p62が液滴の状態でも特異的に連関することを示唆しています。
次に筆者らは、Huh-1細胞内でのULK1の局在を研究しました。抗-ULK1抗体を用いた免疫蛍光染色により、p62-body内でのULK1の顕著なシグナルが観察され、ULK1の減少によりこのシグナルが減少したことが示されました(図2C)。 FIP200、ATG13、およびATG101と共に、ULK1はオートファゴソーム形成の開始キナーゼ複合体を形成します(Lin MG. (2016) Curr. Opin. Cell Biol.)、また、p62はFIP200とClawドメインを介して相互作用します(Turco E. (2019) Mol. Cell)。このことから、ULK1のp62-bodyへの局在は間接的で、p62とFIP200の相互作用に依存する可能性があります。この仮説を検証するために、FIP200欠損Huh-1細胞を用いて実験を行いました。驚くべきことに、これらの細胞でもULK1はp62-bodyに局在し、ULK1のシグナル強度は野生型Huh-1細胞よりも有意に高い結果となりました(図2C)。これは、FIP200ノックアウト細胞内のULK1タンパク質が増加しているためであると考えられます。外来発現させた緑色蛍光タンパク質(GFP)-タグ付きULK1およびULK2も、FIP200の存在に関係なくp62-bodyに局在しました(図2D)。GFP-ULK1を有するHuh-1細胞を用いた電子相関顕微鏡解析により、GFP-ULK1が線状組織から成る丸い構造体に局在していることが示され、これらの構造体は以前p62-bodyと同定されたものでした(Jakobi AJ. (2020) Nat. Commun.、Kageyama S. (2021) Nat. Commun.)(図2E)。これらのデータから、ULK1は直接のULK1-p62相互作用を介してp62-bodyに局在することを示唆しています。
3. p62-body内のULK1の重要性
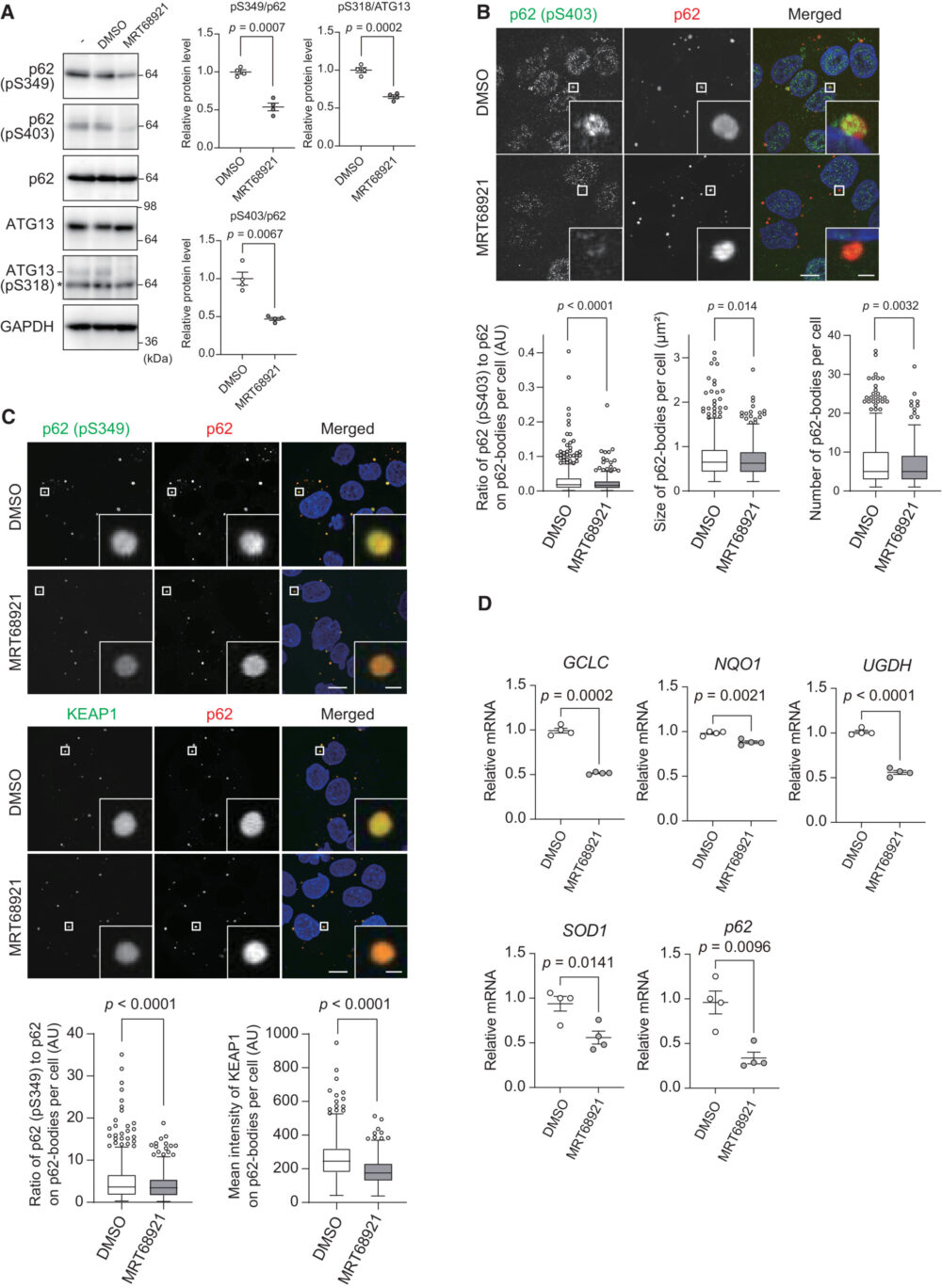
次に、p62-body内でのULK1とULK2の意義を調べるために、ULK1とULK2の最も強力な阻害剤であるMRT68921を使用しました。IC50値はそれぞれ2.9および1.1nMです(Petherick KJ. (2015) J. Boil. Chem.)。予想通り、2.5µMのMRT68921でHuh-1細胞を処理すると、リン酸化されたATG13のレベルだけでなく、Ser349およびSer403リン酸化されたp62形態のレベルも低下しました(図3A)。
彼らは、Ser403がリン酸化されたp62がp62-body内で広範に共局在しているのを観察しました(図3B)。MRT68921でHuh-1細胞を処理すると、p62-body内のSer403リン酸化p62のシグナル強度が弱くなりました(図3B)。MRT68921の処理はp62-bodyのサイズと数を、わずかではあるものの、有意に減少させました(図3B)。これらの結果から、ULK1とULK2はp62のSer403をリン酸化することによってp62のLLPSに寄与する一方、p62-body内でのSer403の脱リン酸化は既に形成されたp62-bodyにはほとんど影響を与えないことが示唆されます。
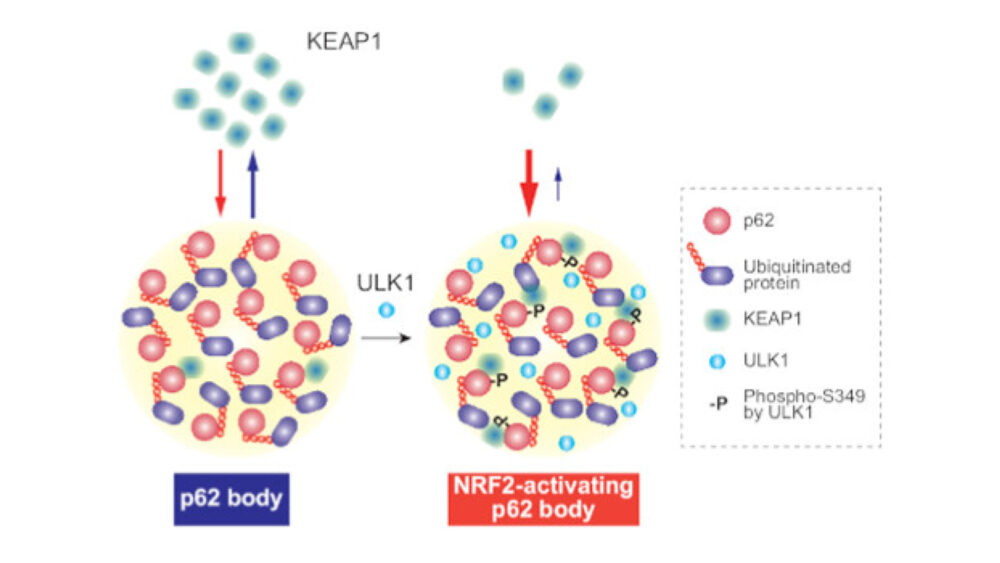
次に、ULK1およびULK2の阻害がp62-body内でのKEAP1の局在に影響を与えるかどうかを検証しました。MRT68921の有無で培養したHuh-1細胞を、抗p62および抗Ser349リン酸化p62特異抗体で免疫染色しました。Huh-1細胞のp62-bodyにはSer349リン酸化p62が含まれていました(図3C)。MRT68921処理すると、p62-body上のリン酸化p62のシグナル強度が著しく低下しました(図3C)。抗p62および抗KEAP1抗体を用いた二重免疫蛍光染色では、KEAP1がp62-body内に広範に局在していることが示されました(図3C)。MRT68921の処理により、p62-body内のKEAP1のシグナル強度が著しく低下しました(図3C)、これはKEAP1がp62-bodyから細胞質に放出され、NRF2が非活性化していることが示唆されます。実際、GCLC、NQO1、UGDH、SOD1、およびp62自体などのNRF2ターゲットの遺伝子発現は、MRT68921処理によって減少しました(図3D)。これらのデータは、p62-body内のULK1およびULK2がp62をSer349でリン酸化し、KEAP1をp62-body内に封じ込めてNRF2の活性化に寄与していることを示唆しています。
4. S349がリン酸化されたp62-body内でのKEAP1のダイナミクス
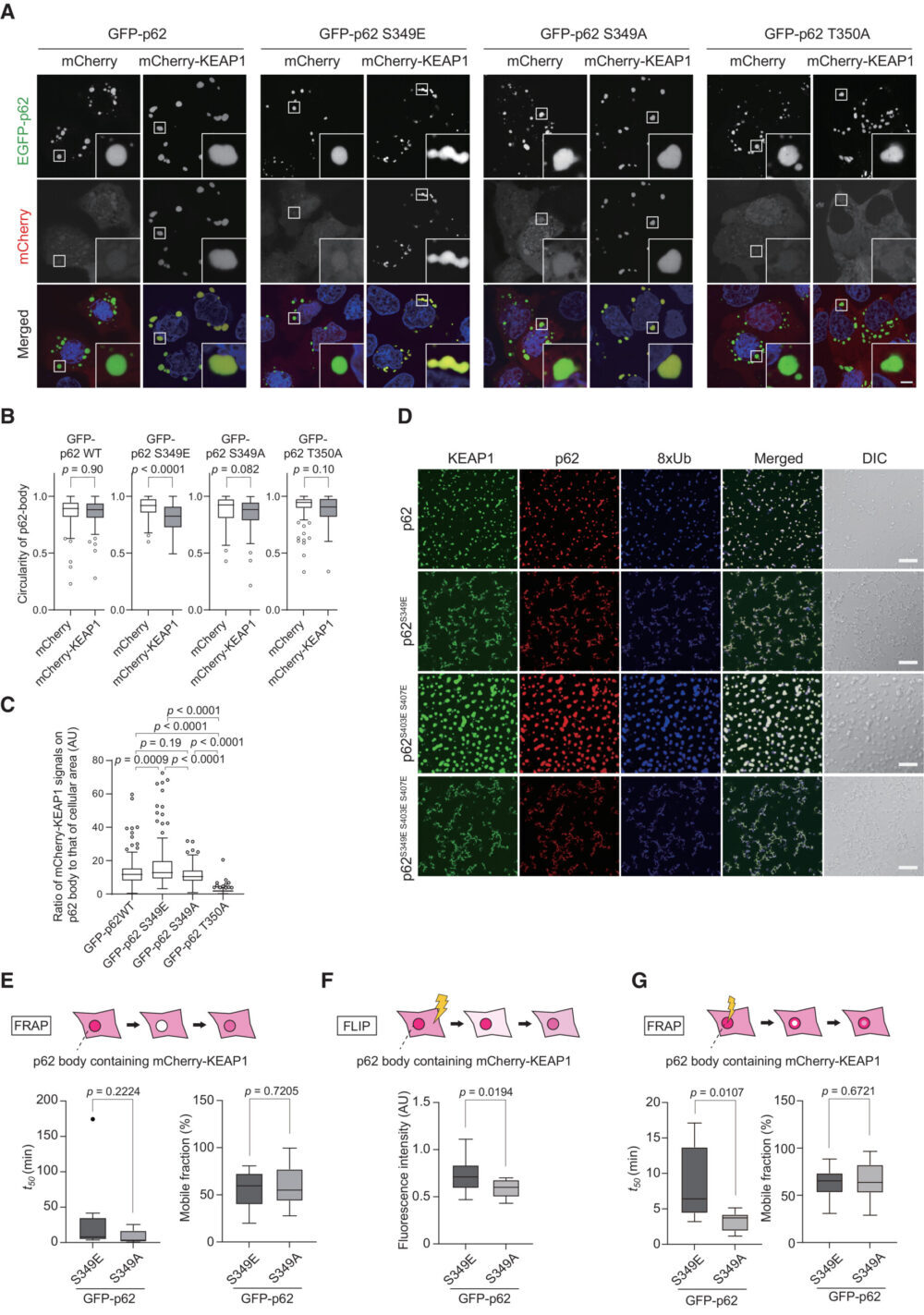
次の一連の実験では、p62のSer349リン酸化がp62-body内のKEAP1のダイナミクスに影響を与えるかどうかを明らかにしました。これを行うために、p62とKEAP1のダブルノックアウトHuh-1細胞を作成し、GFPタグ付きの野生型p62、リン酸化模倣p62S349E(Ichimura Y. (2013) Mol. Cell)、リン酸化不全p62S349A(Ichimura Y. (2013) Mol. Cell)、またはKEAP1との相互作用が阻害されるp62T350A(Komatsu M. (2010) Nat. Cell. Biol.)をmCherryまたはmCherryタグ付きKEAP1と共に発現しました。蛍光観察の結果、mCherry-KEAP1が存在しない場合、野生型GFP-p62およびすべてのGFP-p62変異体は、液滴のような丸い構造を形成しました(図4A)。ダブルノックアウトHuh-1細胞で野生型GFP-p62または変異体をmCherry-KEAP1と共に発現させた場合、mCherry-KEAP1は、GFP-p62T350Aを除いたGFP-p62陽性構造とよく共局在しました(図4A)。彼らは、mCherry-KEAP1の有無で形成された各GFP-p62陽性構造の円形度を測定しました。円形度の値が1に近い場合は液滴に近く、値が低いとゲルまたは凝集体と近くなります(Strom AR. (2017) Nature、Faruk MO. (2021) J. Boil. Chem.)。mCherry-KEAP1が存在しない場合、すべてのGFP-p62陽性構造の値は1に近く(図4B)、それらが液滴であることを示唆しています。驚くべきことに、mCherry-KEAP1と共局在していたとき、GFP-p62S349E-bodyの円形度のみが有意に低下しました(図4B)。また、野生型p62またはさまざまな変異体で構成されるp62-body上のmCherry-KEAP1のシグナル強度を測定すると、mCherry-KEAP1の強度はp62S349E-bodyの方が野生型p62およびp62S349A-bodyよりも高い結果となりました(図4C)。一方、野生型p62とp62S349A-bodyの間にはmCherry-KEAP1の強度に有意な違いはありませんでした(図4C)。さらに、in vitroのLLPSアッセイでは、野生型p62 wild-typeまたはp62S403E S407EにS349E変異を導入することにより、KEAP1の存在下で液滴ではなく無定形の凝集体が形成されることが明らかになりました(図4D)。これらのデータは、S349E変異によるKEAP1とp62の強力な結合が、p62-bodyの生物物理学的特性を変えることを示唆しています。
彼らは「mCherry-KEAP1がSer349リン酸化p62-bodyに取り込まれると、リン酸化p62とKEAP1の間に密接な相互作用があるため、KEAP1のbody外への流出が著しく減少するだろう」と仮説を立てました。これを証明するために、fluorescence recovery after photobleaching(FRAP)とfluorescence loss in photobleaching(FLIP)(Ishikawa-Ankerhold HC. (2012) Molecules)を使用して、GFP-p62S349Eまたはp62S349Aからなるp62-body内へのKEAP1の流入と流出を評価しました。mCherry-KEAP1のGFP-p62S349Eまたはp62S349A-body内への流入を測定するために、GFP-p62S349Eまたはp62S349A-body体内のmCherry-KEAP1の全蛍光をブリーチングし、蛍光回復を測定しました。FRAP実験で分子の動態を特徴づけるのは、回復の半分に達する時間(t50)と可動分率(Reits EA. (2001) Nat. Cell Biol.)です。これらのパラメータに基づくと、周囲からのmCherry-KEAP1の流入は、p62S349Eとp62S349A-bodyでほとんど同じでした(図4E)。次に、GFP-p62-bodyからのmCherry-KEAP1の流出を調べるために、FLIP解析を行いました。細胞領域の約80%がブリーチングされると、細胞質内の蛍光シグナルが一時的に減少し、非ブリーチング領域からの流入により徐々に回復します。mCherry-KEAP1がp62-bodyから流出する場合、ブリーチング後の非ブリーチング領域内でのp62-body内のmCherry-KEAP1の蛍光強度は減少するはずです。p62S349A-body内のmCherry-KEAP1のシグナル強度は、ブリーチング後30分で基準値の約58.2 ± 0.05%に減少しましたが、p62S349E-bodyの場合は依然として高い(72.0 ± 0.07%)でした(図4F)。最後に、GFP-p62-bodyの中央部分をブリーチングした後のmCherry-KEAP1の蛍光回復を測定しました。p62S349E-bodyのt50は8.51 ± 4.83 分であり、これはp62S349A-bodyのもの(3.32 ± 1.23 分)よりもはるかに長くかかりました(図4G)。これらの結果から、p62のSer349リン酸化はKEAP1をp62-bodyに保持し、これが長引くと、これらのbody内の流動性が低下することが示唆されます。
5. マウスにおけるp62 Ser349リン酸化の生理学的重要性
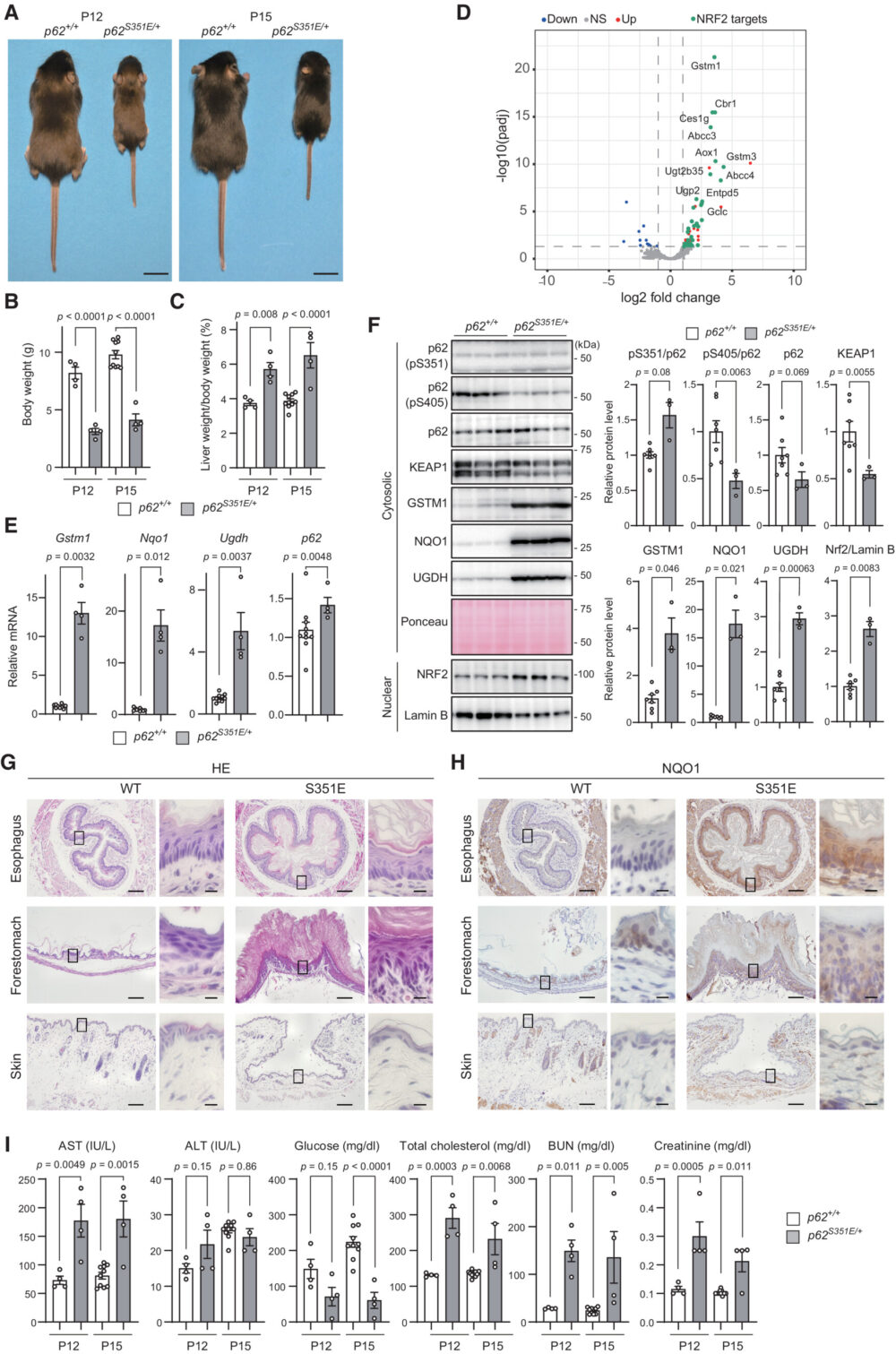
p62 Ser349リン酸化の生理学的役割を明確にするために、Ser351(ヒトのSer349に対応)がGlu(p62S351E/+マウス)に置き換えられたp62を発現するノックインマウスを作製しました。はじめは、CRISPR/Cas9システムを使用して作製しようとしましたが、p62S351E/+マウスは得ることができませんでした。そのため、最近開発されたprime editingというシステムを使用して、マウス胚性幹細胞(mES細胞)を用いてp62S351E/+マウスを作製しようとしました(Anzalone AV. (2019) Nature)。しかし、この方法でも高いキメラ率を持つキメラマウスを得ることはできませんでした。ただ、この方法で低いキメラ率ながらも生殖系列移行が起こったオスのキメラマウスを作製することができました。キメラマウスからの精子を用いた体外受精を行い、実験用の十分な数のヘテロマウスを得ました。その結果、p62S351E/+マウスはP12およびP15で重度の成長遅延と軽度の肝肥大を示しました(図5A-C)。これが、ノックインマウスの作製に難航した理由である可能性が高いです。野生型およびp62S351E/+マウスの肝臓のRNA-seq解析では、NRF2ターゲットの遺伝子発現が増加していることが示されました(図5D)。これらの結果と一致して、リアルタイムPCR解析では、Gstm1、Nqo1、Ugdh、およびp62などのNRF2ターゲットの遺伝子のmRNA発現が、p62S351E/+マウスの肝臓で野生型マウスよりもはるかに上昇していました(図5E)。また、GSTM1、NQO1、UGDHのタンパク質レベルと、NRF2の核内レベルは、p62S351E/+マウスで野生型マウスよりも有意に高かったです(図5F)。KEAP1はp62体に取り込まれます(Kageyama S. (2021) Nat. Commun.)、そしてKEAP1とp62の複合体はオートファジーによって分解されます(Taguchi K. (2012) Proc. Natl. Acad. Sci. USA.)。したがって、p62のSer349のリン酸化はKEAP1との結合親和性を高め、KEAP1の分解を促進するはずです。実際、p62S351E/+マウスではKEAP1のタンパク質レベルが野生型マウスと比較して低下していました(図5F)。これらの結果から、p62S351Eの発現が内因性p62の半分でも、KEAP1の非活性化とその後のNRF2の活性化には十分であることを示しています。解剖学的な分析において、ヘマトキシリン・エオシン(HE)染色によると、p62S351E/+マウスの食道と前胃には野生型マウスよりも明らかに厚い角質層がありましたが、皮膚にはそのような違いはありませんでした(図5G)。前胃では、角質層の下の上皮層がp62S351E/+マウスでは野生型マウスよりもわずかに厚くなっていましたが、食道ではそれは確認できませんでした。免疫組織化学(IHC)により、食道と前胃の上皮でNQO1の強度がp62S351E/+マウスでは野生型マウスよりも高いことが示されました(図5H)。p62S351E/+マウスからの血清データによれば、ややですが有意なAST(アスパラギン酸アミノトランスフェラーゼ)値の上昇、栄養不良の兆候(低血糖および高コレステロール)、脱水の兆候(高尿素窒素およびクレアチニンの上昇)が示されました(図5I)。これらの結果は、p62S351E/+マウスがKeap1欠損マウスのフェノコピーであり、食道と前胃の過角質化による栄養摂取の障害がp62S351E/+マウスの重度フェノタイプの主要な原因である可能性が高いことを強く示唆しています。これらの結果から、Ser351のp62のリン酸化は、おそらく酸化還元非依存のKEAP1-NRF2経路を調節するために、体内でNRF2活性を制御するために生理学的に重要であることを示しています。
まとめ
NRF2は通常、酸化ストレス応答を調節する転写因子であり、一般に酸化還元依存的な方法で制御されます。液-液相分離によって形成されるp62-bodyは、Ser349がリン酸化されたp62を含み、酸化還元非依存的なNRF2の活性化に関与します。ただし、p62のリン酸化の調節メカニズムと生理学的な意義は解明されていませんでした。この研究では、p62のリン酸化に関与するキナーゼとしてULK1を同定しています。ULK1はp62-bodyと共局在し、直接p62と相互作用します。ULK1に依存するp62のリン酸化により、KEAP1がp62-body内に保持され、それによりNRF2が活性化されます。p62S351E/+マウスは、ヒトのSer349に相当するSer351がGluで置換されている、リン酸化模倣マウスです。これらのマウスは、そのリン酸欠陥型p62S351A/S351Aとは異なり、NRF2の過活性化と成長遅延を示します。この遅延は、皮膚角化症に伴う食物摂取障害と脱水症状にとるものであり、これは全身的なKeap1ノックアウトマウスでも観察される現象です。この研究結果は、酸化還元非依存的なNRF2活性化経路の生理学的重要性に関与する理解を広げ、このプロセスにおける相分離の役割についての新たな見解をもたらすものです。
この研究で使っている手法の解説記事