Senescent cells form nuclear foci that contain the 26S proteasome
Tomohiro Iriki, Hiroaki Iio, Shu Yasuda, Shun Masuta, Masakazu Kato, Hidetaka Kosako, Shoshiro Hirayama, Akinori Endo, Fumiaki Ohtake, Mako Kamiya, Yasuteru Urano, Yasushi Saeki, Jun Hamazaki, Shigeo Murata
要約
プロテアソームは、細胞内のタンパク質分解において中心的な役割を果たします。プロテアソーム活性が加齢に伴って低下することは、細胞および生体の老化と関連していますが、老化細胞においてプロテアソームがどのような役割を果たすのか、そのメカニズムはまだ解明されていません。この研究では、老化細胞内でプロテアソームを含む液体のような性質を持つ核小体が形成されることを示しています。老化関連核プロテアソーム小体(senescence-associated nuclear proteasome foci; SANPs)は、基地の核プロテアソーム小体と同様にユビキチン化とRAD23Bに依存していますが、プロテアソーム活性も必要です。RAD23BのノックダウンはSANPの形成を抑制し、ミトコンドリア活性を増加させ、細胞周期停止や細胞形態などの他の老化特性には影響を与えず、活性酸素種の産生を引き起こします。これらの結果は、SANPが老化細胞の重要な特徴であり、プロテアソームが老化細胞においてどのような役割を果たすかのメカニズムを明らかにするものです。
はじめに
細胞老化について
体細胞が細胞分裂できる回数は限られており、分裂可能な回数が減っていくことを細胞老化と呼びます(Hayflick L. (1961) Exp. Cell Res.)。細胞老化は、DNA損傷、テロメアの短縮、rasがん遺伝子の活性化、活性酸素種(ROS)といった潜在的ながん原性ストレスによって誘導されるため、細胞老化は細胞の増殖を停止させて腫瘍抑制機能を発揮すると考えられています。その一方で、細胞老化は動脈硬化、神経変性疾患、がんなどの加齢関連疾患に寄与することが報告されています。老化細胞の蓄積は、老齢のマウス、サル、ヒトにおいて報告されており(Muñoz-Espín D. (2014) Nat. Rev. Mol. Cell Biol.)、老化細胞をマウスから除去することで、老化に関連した病理を遅延させ、健康寿命を延ばすことを報告する研究もあります(Baker DJ. (2011) Nature、Baker DJ (2016) Nature)。したがって、老化細胞の蓄積を抑制することは、加齢関連の疾患を予防するための、非常に有望な戦略となり得ます。
プロテアソームと老化の関連について
26Sプロテアソームは、プロテアーゼ20Sコア部位(core particle; CP)と19S調節部位(regulatory particle; RP)から成る、非常に大きなプロテアーゼ複合体です。RPはCPの両端に結合し、ユビキチン鎖を認識し、基質の解きほぐしを行うことで、基質のCPへの導入を制御しています。プロテアソームの機能はさらに多くのプロテアソーム相互作用タンパク質によって調節されます。プロテアソームは、ユビキチン化されたタンパク質の調節されたタンパク質分解を触媒することにより、細胞周期、転写制御、炎症反応、タンパク質恒常性など多くの生物学的プロセスで中心的な役割を果たしています。これまでの研究では、プロテアソーム活性の年齢依存的な低下とタンパク質恒常性の破綻が、老化と加齢関連疾患を促進することが報告されています(Vilchez D. (2014) Nat. Commun.、Campisi J. (2019) Nature、López-Otín C. (2013) Cell)。また最近の研究では、プロテアソーム活性の阻害が、ヒト線維芽細胞で複製寿命を短縮し、老化様の表現系を引き起こすことが報告されています(Chondrogianni N. (2003) J. Biol. Chem.、Torres C. (2006) J. Cell. Physiol.)。さらに他の研究では、老化細胞でプロテアソーム活性が低下する一方で、プロテアソームサブユニットβ5の過剰発現がヒト線維芽細胞や間葉系幹細胞でプロテアソーム活性を増加させ、複製寿命を延ばすことが示されています(Chondrogianni N. (2003) J. Biol. Chem.、Chondrogianni N. (2005) J. Biol. Chem.、Kapetanou M. (2017) Free Radic. Biol. Med.)。また、プロテアソームの生合成が不全となるPAC1欠損ヘパトサイトは、早期の老化を示すことも明らかにされています(Sasaki K (2010) MCB)。これらの報告は、プロテアソーム機能の変化が細胞老化と密接に関連していることを示していますが、老化細胞内のプロテアソームの特性、プロテアソームが老化細胞でどのような役割を果たしているのかというメカニズムは、解明されていません。
この研究の目的
この研究では、老化細胞内でのプロテアソームの発現、活性および細胞内局在について、ひいてはプロテアソームが老化細胞でどのような役割を果たしているのかを明らかにすることを、目的としています。この研究を通して、26Sプロテアソームが老化細胞内の核内の小体に局在し、これらの小体がミトコンドリアのROS産生の抑制に寄与する可能性があることが発見されました。これは、老化細胞内での26Sプロテアソームの調節機構を示唆するものです。
1. 老化細胞において、プロテアソームの発現と活性は減少する
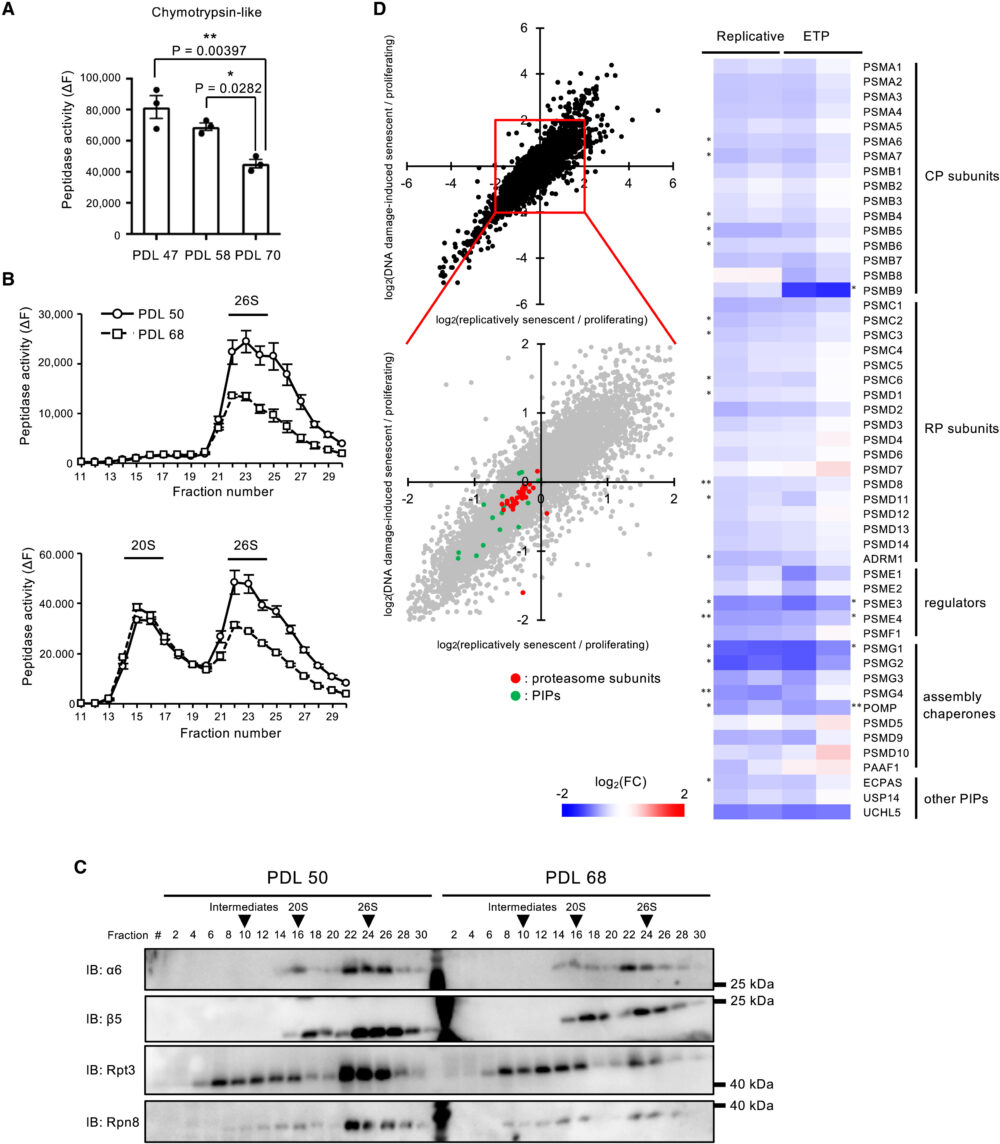
これまでの研究において、複製によって老化したヒト線維芽細胞や間葉系幹細胞において、プロテアソーム活性が低下していることが報告されていました(Vilchez D. (2014) Nat. Commun.、Chondrogianni N. (2003) J. Biol. Chem.、Kapetanou M. (2017) Free Radic. Biol. Med.)。しかし、細胞老化にともなうプロテアソームの変化については明らかになっていませんでした。そこで、細胞老化がプロテアソームに与える影響を明らかにするため、ヒト正常二倍体線維芽細胞WI-38を異なる分裂回数(population-doubling levels; PDLs)で使い、細胞が分裂停止するまで連続的に培養して細胞老化を誘導しました。プロテアソームのペプチダーゼ活性は、老化細胞(PDL70)では増殖中の細胞(PDL47および58)と比較して低下していました(図1A)。また、PDLが増加するにつれてプロテアソーム活性が徐々に低下することから、プロテアソーム活性は細胞老化の前に低下することがわかりました。この活性低下は26Sプロテアソームにのみ見られ、20Sプロテアソームの活性は増殖中の細胞と同等でした(図1B)。26Sプロテアソームの活性低下は、26Sプロテアソームの量の減少によるものであることが、ウェスタンブロットの結果から示唆されます(図1C)。
プロテアソーム活性の低下のメカニズムを理解するために、細胞老化およびDNA損傷による老化WI-38細胞を用いて、増殖中のWI-38細胞をコントロールとして、プロテオーム解析を行いました。DNA損傷による細胞老化の誘導には、WI-38細胞にトポイソメラーゼII阻害剤であるエトポシド(ETP)処理を行いました。多くのプロテアソームサブユニットおよびプロテアソームと相互作用するタンパク質(PIPs)が、老化細胞において低下していました(図1D)。これは、プロテアソームサブユニットおよびPIPsの発現の減少が、老化細胞におけるプロテアソーム活性の低下の一因であることを示唆しています。
2. 老化細胞は核内に、26Sプロテアソームを含む小体を形成する
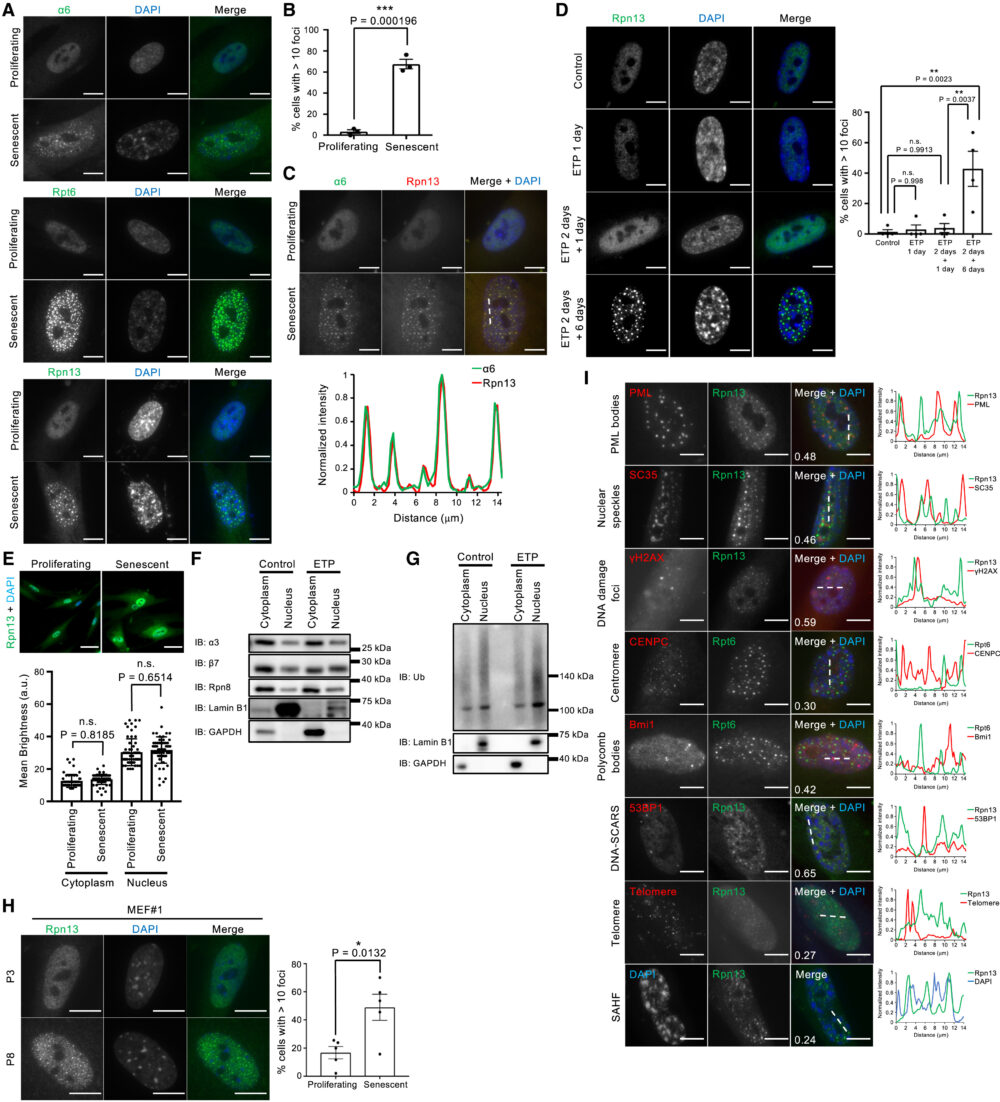
老化細胞におけるプロテアソームをさらに特徴づけるため、プロテアソームの細胞内での局在を調べました。これまでの研究から、プロテアソームの局在は細胞の状態によって異なる(例:細胞周期の段階や栄養条件)とされています(Wójcik C. (2003) Int. J. Biochem. Cell Biol.、Russell S.J. (1999) J. Biol. Chem.)。増殖中および老化WI-38細胞を、プロテアソームのCPサブユニットα6およびRPサブユニットRpt6、Rpn13に対する抗体を用いて免疫染色しました。増殖中の細胞では、プロテアソームサブユニットは核内全体に均一に分布していました。対照的に、これらのサブユニットは老化細胞の核内で複数箇所に集まって局在していました(図2A)。プロテアソームサブユニットを含む核内の小体は、老化細胞の約60%に存在していましたが、増殖中の細胞ではほとんど見られませんでした(図2B)。さらに、α6とRpn13のサブユニットは核内の小体で共局在しており、これは26Sプロテアソームとして存在していることを示しています(図2C)。
次に、核プロテアソーム小体の形成が、細胞老化誘導刺激に依存するかどうかを調べました。WI-38細胞をETPで2日間処理し、ETP除去後1日後もしくは6日後にRpn13の免疫染色を行い、時間経過によるプロテアソーム小体の出現を観察しました。ETP処理中(ETP 1day)およびETP処理から1日後(ETP 2days + 1 day)には核プロテアソーム小体は観察されませんでした。小体はETP処理から6日後(ETP 2 days + 6 days)に急激に増加しました(図2D)。この結果から、核プロテアソーム小体の形成は細胞老化によるもので、老化誘導刺激自体によってはトリガーされないことが示唆されます。これは、以前の研究で示された老化誘導刺激の数日後に老化現象が現れるという結果と一致しています(Narita M. (2003) Cell、Malaquin N. (2016) Exp. Gerontol.)。
つづいて彼らは、細胞質のプロテアソームが核に移動して核プロテアソーム小体を形成すると、仮説を立てました。しかし、老化によって核・細胞質のプロテアソーム量ともに変化しないことが、免疫染色(図2E)・細胞分画後のウェスタンブロット(図2F)でも確認されました。ただし、老化細胞では核内のユビキチン化タンパク質がわずかに増加しており(図2G)、これはプロテアソーム小体の形成と関連している可能性があります。
さらに、老化したマウス胚性線維芽細胞(MEFs)においても、核プロテアソーム小体が観察されました(図2H)。さらに他の細胞株や他の老化誘導においても、核プロテアソーム小体を確認しています。これらの結果から、核プロテアソーム小体は老化細胞で広く見られる現象であることが示唆されます。
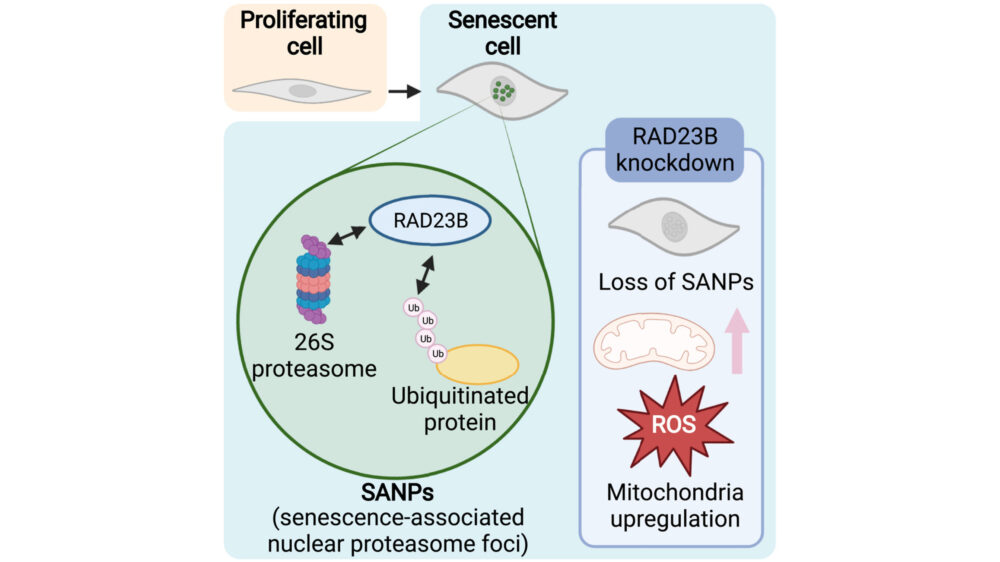
これまで、多数の核内体とその局在について報告がありました。そこで、これらの既知の核内体のいずれかにプロテアソームが局在するかを調べるため、各マーカーとプロテアソームサブユニットとの共免疫染色を行いました。しかし、核プロテアソーム小体は、調べたいずれの核内体とも共局在しませんでした(図2I)。したがって、老化細胞内の核プロテアソーム小体は新たな核内体であると考えられ、老化関連核プロテアソーム小体(senescence-associated nuclear proteasome foci; SANPs)と名付けられました。
3. 老化関連核プロテアソーム小体は液体のような性質をもつ
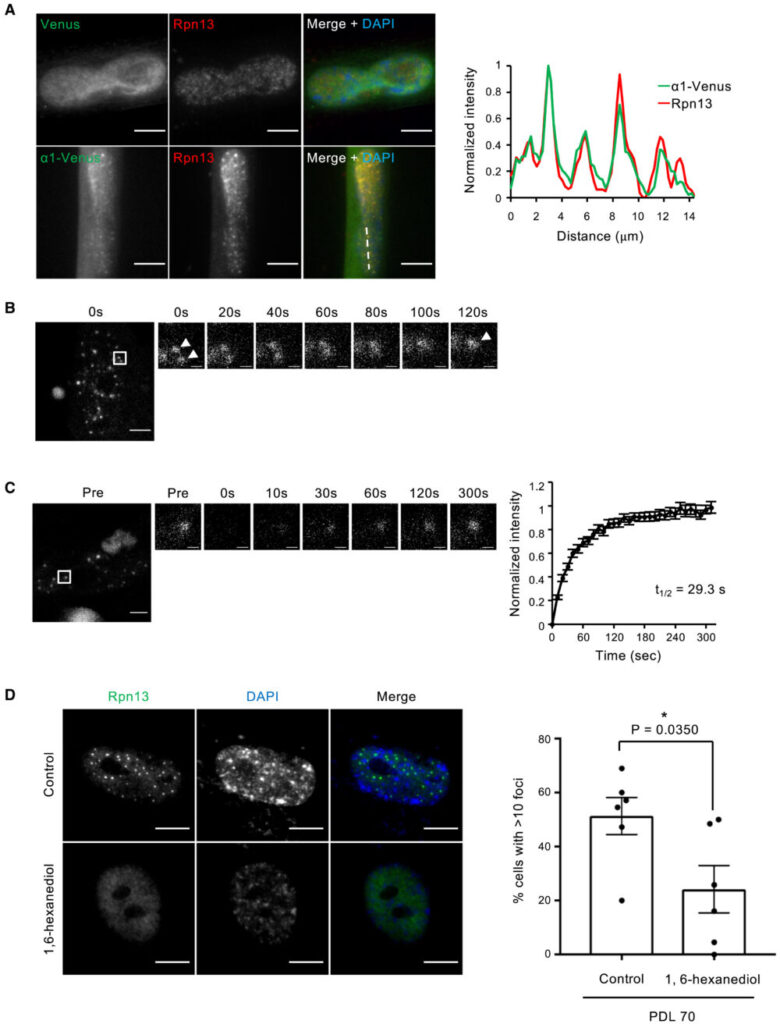
高浸透圧やアミノ酸欠乏によって誘導されるプロテアソーム小体をはじめとした多くの生体分子凝集体は、液-液相分離(Liquid-Liquid Phase Separation; LLPS)によって形成されています(Yasuda S. (2020) Nature、Uriarte M. (2021) Nat. Commun.、Alberti S. (2019) Cell)。そこで次に、SANPの生物物理学的特性を調べました。生細胞内でプロテアソームの局在を調べるため、WI-38細胞にプロテアソームサブユニットα1のC末端にVenusタグを付加したタンパク質(α1-Venus)を発現させました。α1-Venusは内因性のRpn13の免疫染色からSANPに局在していることが確認できました(図3A)。このことから、α1-Venusを用いて26Sプロテアソームを観察することができます。この細胞を用いたライブセルイメージング解析から、SANPが時間経過とともに融合することが確認されました(図3B)。まら、FRAP解析では、SANPが蛍光退色後数分で蛍光が回復し、プロテアソームが小体と周囲の核質との間を移動していることが示されています(図3C)。さらに、弱い疎水性相互作用を崩す化合物である1,6-hexanediol処理で、SANPは消失しました(図3D)。これらの結果は、SANPがLLPSの特性を示す液体状の特性を持つことを示しています。
4. SANP形成には活性のあるプロテアソームとK48-ユビキチン鎖が必要である
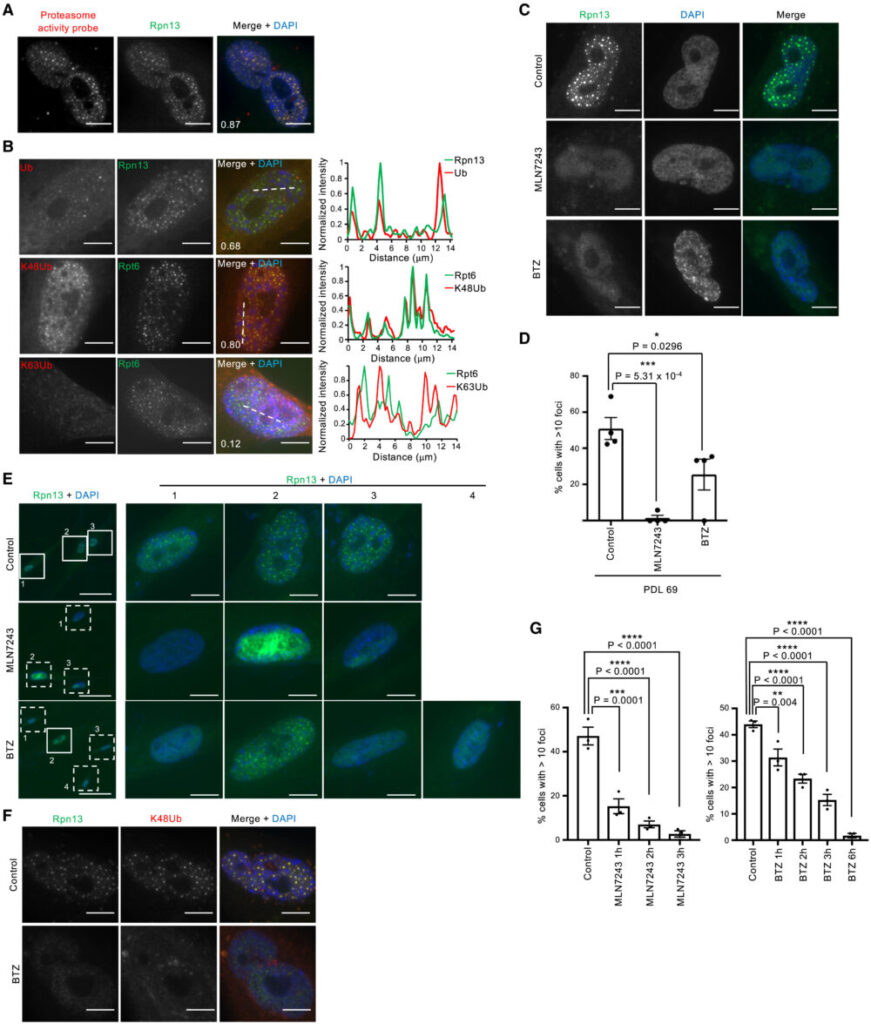
活性ベースのプロテアソームプローブMe4BodupyFL-Ahx3Leu3VSを用いて行ったSANPの染色では、SANPには活性のある26Sプロテアソームが局在していることが示されました(図4A)。さらに、主要なプロテアソームでの分解シグナルであるK48ユビキチン鎖がSANPに局在しており、主にプロテアソーム以外の経路で機能するK63ユビキチン鎖は共局在していないことがわかりました(図4B)。老化細胞にE1ユビキチン活性化酵素の阻害剤であるMLN7243を処理すると、SANPを持つ細胞の集団を有意に減少させ、ユビキチン化反応がSANP形成に必要であることが示されました(図4C-E)。さらに興味深いことに、プロテアソーム阻害剤であるボルテゾミブ(BTZ)処理でもSANP形成が減少しました(図4C, D)。BTZ処理はプロテアソーム陽性小体だけでなく、ユビキチン陽性小体も消失させました(図4F)。さらにMLN7243処理とBTZ処理ともに、SANP陽性細胞の数を時間依存的に減少させました(図4G)。これらの結果は、ユビキチン化反応と活性プロテアソームがSANP形成に必要であることを示しています。
5. RAD23BがSANP形成に必要である
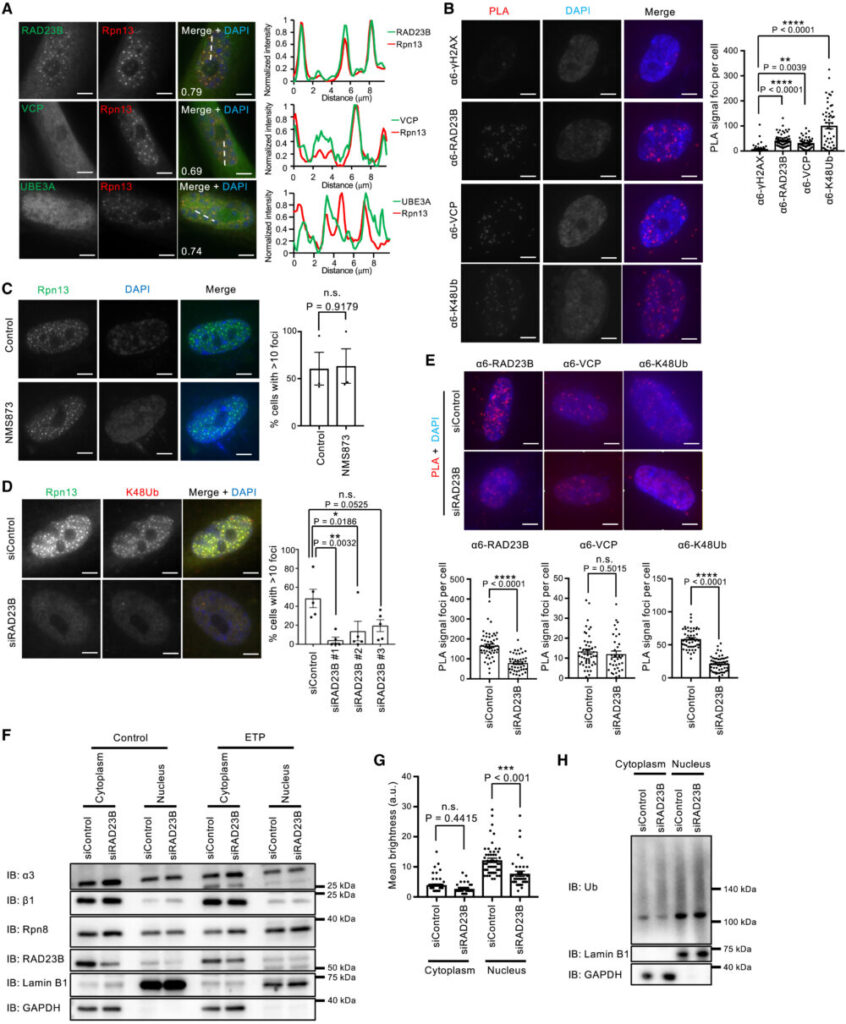
高浸透圧により誘導される核プロテアソーム小体には、シャトル因子RAD23B、ユビキチン選択的シャペロンp97/VCP、ユビキチンリガーゼUBE3Aが共局在しています(Yasuda S. (2020) Nature)。そこでSANPが同じ構成要素になっているか確認するため、プロテアソームサブユニットRpn13をRAD23B、p97/VCP、UBE3Aと共免疫染色を行いました。その結果、RAD23Bとp97/VCPはSANPとの共局在が見られましたが、UBE3Aははっきりとした小体を形成しておらず、またすべてのSANPにUBE3Aが多く存在しているわけではありませんでした(図5A)。SANP(プロテアソームCPサブユニットα6により検出)とRAD23B、p97/VCPの近接性は、近接ライゲーションアッセイ(proximity ligation assay)によって確認されました(図5B)。
つづいて、RAD23Bとp97/VCPがSANP形成に必要かどうかを調べました。p97/VCP阻害剤NMS873はSANP形成に影響を与えませんでした(図5C)。一方、siRNAを用いたRAD23Bノックダウンは、SANPを持つ細胞数を減少させました(図5D)近接ライゲーションアッセイでは、RAD23Bノックダウンでα6とユビキチンとの相互作用が減少していることが確認できましたが、p97/VCPとの相互作用には影響がありませんでした(図5E)。これらの結果から、RAD23BはSANP形成に必要であり、プロテアソームとユビキチン化タンパク質との相互作用はRAD23Bに依存していることが示唆されます。
RAD23Bはシャトル因子なので、RAD23Bノックダウンがプロテアソームとユビキチン化タンパク質を核から細胞質への移行を促進することで、SANPが形成できなくなっている可能性があります。しかしRAD23Bのノックダウンは、プロテアソームおよびユビキチン化タンパク質の細胞質-核比に影響がありませんでした(図5F-H)。
6. 老化細胞においてSANPsはミトコンドリア活性化とROS産生を抑制する
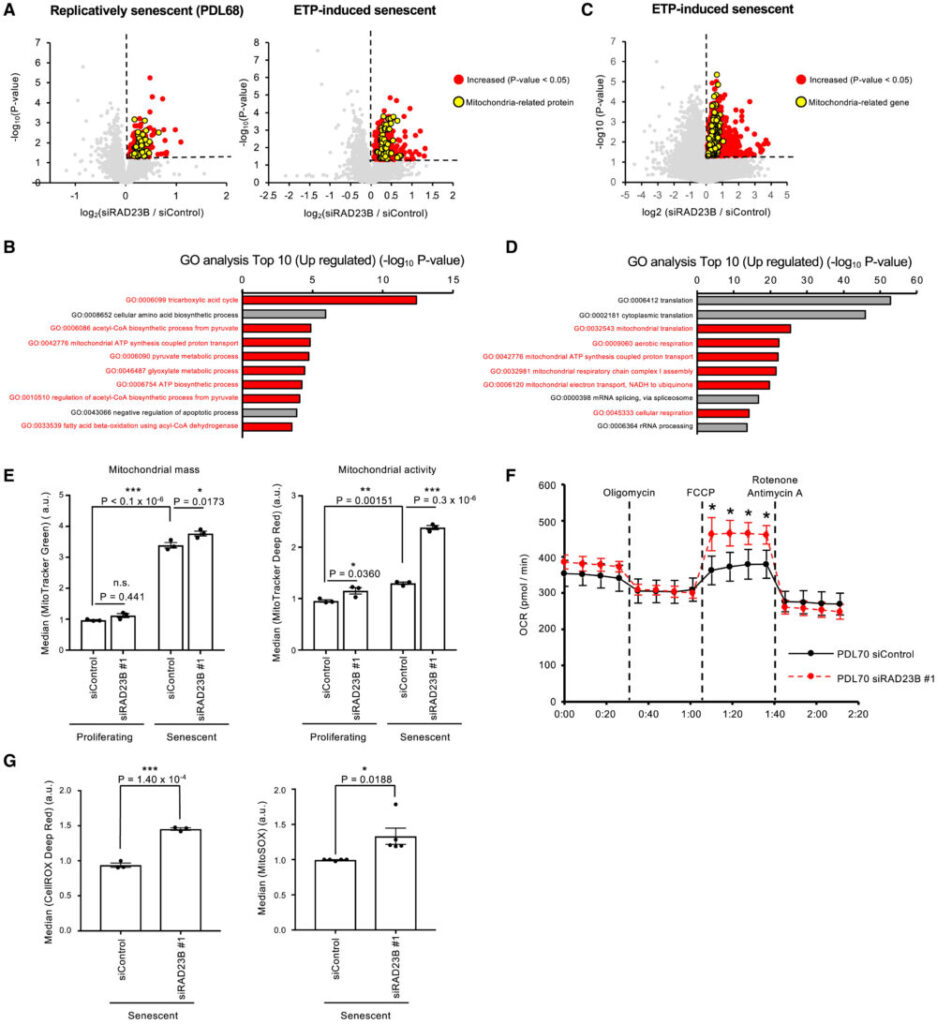
ここで、SANPがユビキチン化された核内タンパク質を分解する場所として機能するのではないかと仮説を立てました。SANPで分解される可能性のある基質タンパク質を同定するため、Tandem mass tag (TMT)ベースのプロテオーム解析を行いました。RAD23Bをノックダウンした老化細胞では、コントロールの老化細胞と比較してミトコンドリア関連タンパク質が増加していることがわかりました(図6A、B)。これは、SANPがミトコンドリア機能を抑制している可能性を示しています。つづいて、ミトコンドリア関連タンパク質の増加に寄与する経路を探るため、RNA-seq解析を行いました。その結果、コントロールと比較して、RAD23Bをノックダウンした老化細胞でミトコンドリア関連遺伝子の発現が増加していることがわかり、プロテオーム解析の結果を支持するものでした(図6C、D)。
ROSは主にミトコンドリアから生じ、これが細胞老化に関与していると考えられている。したがって、SANPとミトコンドリア機能の関係を、MitoTracker GreenおよびDeep Redによる染色でミトコンドリアの量と活性を測定することで検証しました。老化細胞のミトコンドリア量は増加し、その増加に伴ってミトコンドリア活性も増加していました。特にRAD23Bノックダウンは、老化細胞でのみミトコンドリア活性を増加させ、ミトコンドリア量は変化させませんでした(図6E)。この結果と一致するように、細胞外フラックス解析ではRAD23Bノックダウンが最大ミトコンドリア呼吸を増加させることが示されました(図6F)。さらに、RAD23Bノックダウンは老化細胞で細胞およびミトコンドリアのROS産生を増加させました(図6G)。増加したミトコンドリアタンパク質がSANPの直接の基質ではないため、SANPによってどのようなタンパク質が分解させるかは特定されませんでした。これらの結果から、SANPが老化細胞においてミトコンドリア機能およびミトコンドリアからのROS産生を抑制する役割を果たす可能性があり、この研究では同定されなかった各タンパク質の分解を介して行われる可能性があります。
7. SANPsで老化状態が変わるわけではない
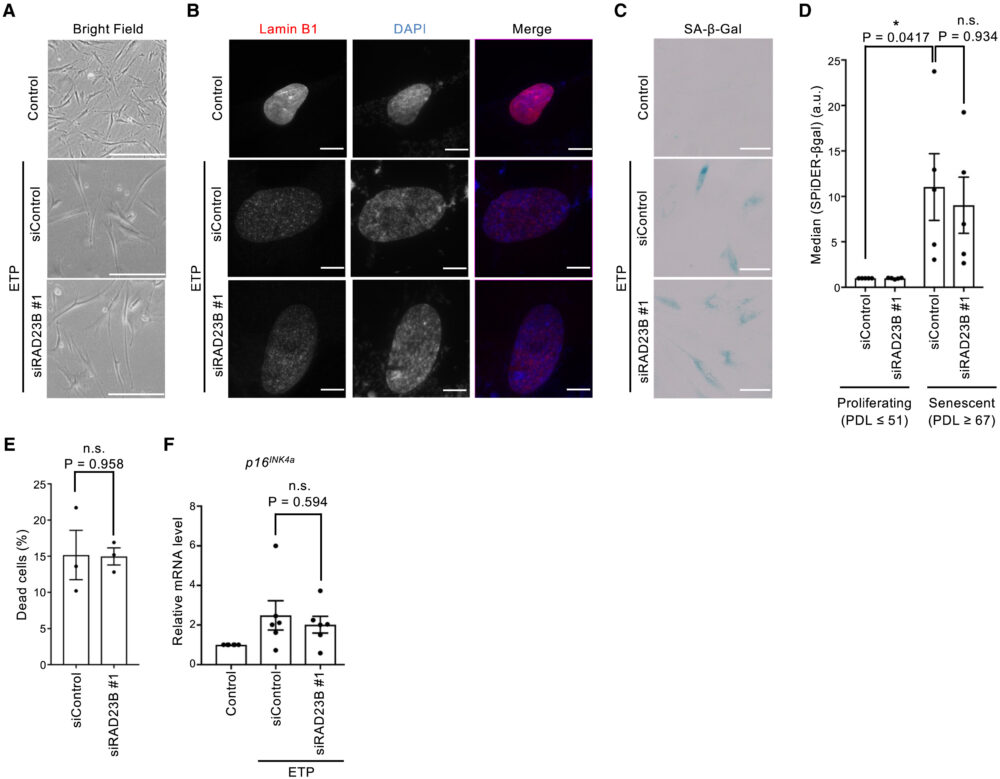
最後に、SANPが老化状態にたいして与える影響を評価するため、SANPの存在しない老化細胞において老化関連の特性を評価しました。RAD23Bのノックダウンは、老化細胞特有の膨張・平坦な携帯およびlamin B1タンパク質発現の減少に影響を与えませんでした(図7A、B)。SA-β-gal活性および生存率も有意な影響は受けず、SANPの有無は細胞が老化によって呈する表現型を変化させないことを示しています(図7C-E)。この結果と一致するように、RAD23Bのノックダウンはp16INK4aの発現にも有意な影響を与えず、SANPは老化の状態を変化させないことを示唆しています(図7F)。
まとめ
プロテアソームは、細胞内のタンパク質分解において中心的な役割を果たします。プロテアソーム活性が加齢に伴って低下することは、細胞および生体の老化と関連していますが、老化細胞においてプロテアソームがどのような役割を果たすのか、そのメカニズムはまだ解明されていません。この研究では、老化細胞内でプロテアソームを含む液体のような性質を持つ核小体が形成されることを示しています。老化関連核プロテアソーム小体(senescence-associated nuclear proteasome foci; SANPs)は、基地の核プロテアソーム小体と同様にユビキチン化とRAD23Bに依存していますが、プロテアソーム活性も必要です。RAD23BのノックダウンはSANPの形成を抑制し、ミトコンドリア活性を増加させ、細胞周期停止や細胞形態などの他の老化特性には影響を与えず、活性酸素種の産生を引き起こします。これらの結果は、SANPが老化細胞の重要な特徴であり、プロテアソームが老化細胞においてどのような役割を果たすかのメカニズムを明らかにするものです。
この研究で使っている手法の解説記事