NRF3 activates mTORC1 arginine-dependently for cancer cell viability
Shuuhei Hirose, Tsuyoshi Waku, Misato Tani, Haruka Masuda, Keiko Endo, Sanae Ashitani, Iori Aketa, Hina Kitano, Sota Nakada, Ayaka Wada, Atsushi Hatanaka, Tsuyoshi Osawa, Tomoyoshi Soga, Akira Kobayashi
- 要約
- はじめに
- 1. NRF3はmTORC1を活性化させる
- 2. NRF3はアミノ酸、特にアルギニンに応答してmTORをリソソームへリクルートする
- 3. NRF3はアルギニン欠乏で活性化し、SLC38A9とRagCの発現を誘導する
- 4. NRF3は、RAB5によるマクロピノサイトーシス・SLC7A1による輸送により、アルギニンの取り込みを促進させる
- 5. NRF3はワールブルグ効果、特にグルコース代謝経路に関与する
- 6. NRF3-mTORC1経路を阻害すると、ミトコンドリアに異常をきたしてアポトーシスが引き起こされる
- 7. NRF3-mTORC1経路が異常活性化すると、腫瘍が増大し予後が悪くなる
- まとめ
- この研究で使っている手法の解説記事
要約
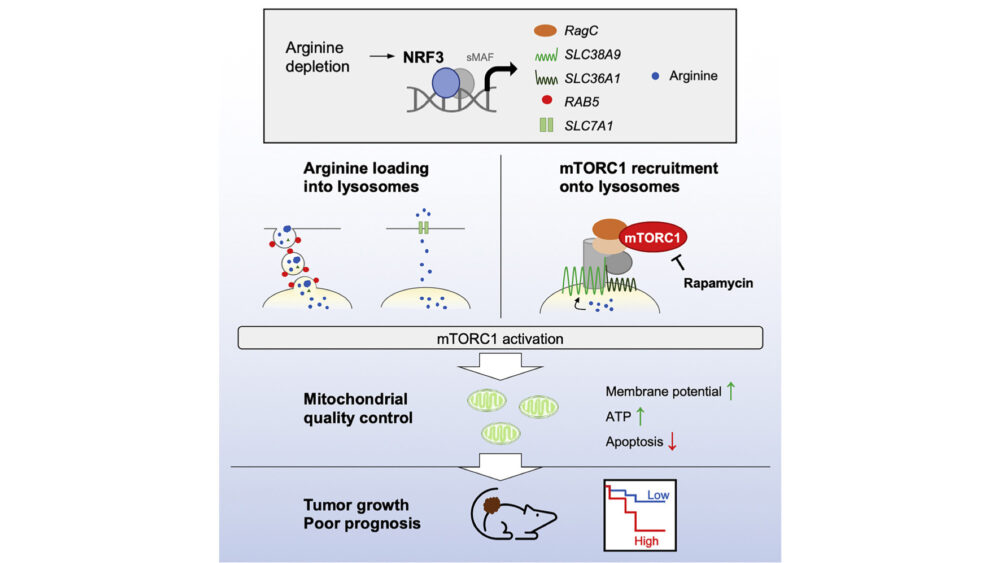
がん細胞は、栄養状況に応じて非常に速く増殖するため、mTORC1シグナルや代謝経路を調整します。CNCファミリー転写因子であるNRF3はがんの進展を促進することがわかっていましたが、がん細胞におけるNRF3とmTORC1の関係は未解明でした。本研究では、NRF3がアミノ酸、特にアルギニンに応答してmTORC1を活性化し、がん細胞を生存させていることが明らかになりました。NRF3は、アルギニン依存的なmTORC1のリソソームへのリクルートのために、SLC38A9やRagCの発現を促進します。また、RAB5によるマクロピノサイトーシスやSLC7A1による選択的輸送を介したアルギニンのリソソームへの輸送を、NRF3が促進させます。さらに、NRF3-mTORC1経路を抑制すると、ミトコンドリア機能が低下し、がん細胞のアポトーシスを誘導します。逆に、この経路が過剰に活性化すると、腫瘍が増殖し、予後が悪くなることが分かりました。この研究は、NRF3とアルギニン依存的なmTORC1活性化の関係について新たな知見をもたらし、がんの進展に関する病態生理学的な側面が明らかになりました。
はじめに
がん細胞が増殖するためには多くの栄養が必要であることがわかっており、低栄養環境に適応するために細胞内代謝をリプログラミングしていることが知られています(Ward PS. (2012) Cancer Cell.)。
転写因子NRF3について
NRF3は、ストレス応答型の転写因子で、通常は小胞体でプロテアソームによりタンパク質分解を受けています。プロテアソームを阻害すると、アスパラギン酸プロテアーゼDDI2により切断、小胞体から核へ移行して標的遺伝子を発現させることがわかっています(Chowdhury AMMA. (2017) Sci. Rep.)。
これまでの研究でNRF3は、以下のような観点からがんの増悪に関わっていることがわかっています。
- さまざまながんにおいて高発現している(Aono S. (2019) Int. J. Mol. Sci.,
- Waku T. (2020) Mol. Cell Biol.)
- がん抑制因子であるp53・Rbを分解することで腫瘍の増大に関わる(Waku T. (2020) Mol. Cell Biol.)
- 膵臓がんや甲状腺がんで転移を促進させている(Wang C. (2017) JCI insight, Wang H. (2018) Cell Cycle)
- コレステロール生合成のマスター因子であるSREBP2を活性化させる(Waku T. (2021) iScience)
さらに、NRF3とよく似た因子であるNRF1は、脂肪酸合成に重要な因子であるSREBP1によって、さらにその上流のmTORC1シグナル経路によって、発現誘導されていることが明らかにされています(Zhang Y. (2014) Nature)。
これらの観点から、NRF3はがんの代謝・mTORC1シグナルと関連があることが予想されます。
細胞増殖を制御する因子mTORC1について
mTORC1は、タンパク質や脂質、核酸といった細胞の構成材料の合成するための同化反応を促進させ、オートファジーといった異化反応を抑制させます。具体的には、リボソームタンパク質のS6K(S6 kinase)と翻訳開始因子である4E-BP1(4E-binding protein 1)をリン酸化して活性化させて、タンパク質合成を促進させます(Hara K. (1998) J. Biol. Chem.)。その他にも、脂質や核酸を供給するため、コレステロール合成やペントースリン酸経路を活性化させます(Porstmann T. (2008) Cell Metab., Du K. (2010) Mol. Cell)。さらに、ミトコンドリアの品質管理により、酸化的リン酸化から解糖系へとシフトさせています(Morita M. (2013) Cell Metab.)。一方で異化反応の抑制は、AMPK(AMP-activated protein kinase)によりオートファジーの活性化シグナルを抑制することで行われています(Ling NXY. (2020) Nat. Metab.)。
mTORC1活性は、リソソーム表面のRhebとRag GTPaseタンパク質で細胞内の栄養状況を感知することで、調節されています。Rag GTPaseはリソソームに局在し、ロイシンやアルギニンといった特定のアミノ酸に応答して、mTORC1をリソソーム表面へリクルートします(Sancak Y. (2010) Cell, Wolfson RL. (2016) Science, Bar-Peled L. (2013) Science, Wang S. (2015) Science)。さらにインスリンといった成長因子により、RhebへのGTP結合が促進されて、mTORC1が活性化します。
この研究の目的
上記のように、mTORC1が活性化するタンパク質レベルでの分子メカニズムは解明されてきましたが、転写による遺伝子発現レベルでの調節についてはよく分かっていませんでした。そこでこの研究では、がんの増悪に関わる転写因子NRF3と代謝、特にmTORC1との関連について明らかにすることを目的としています。
1. NRF3はmTORC1を活性化させる
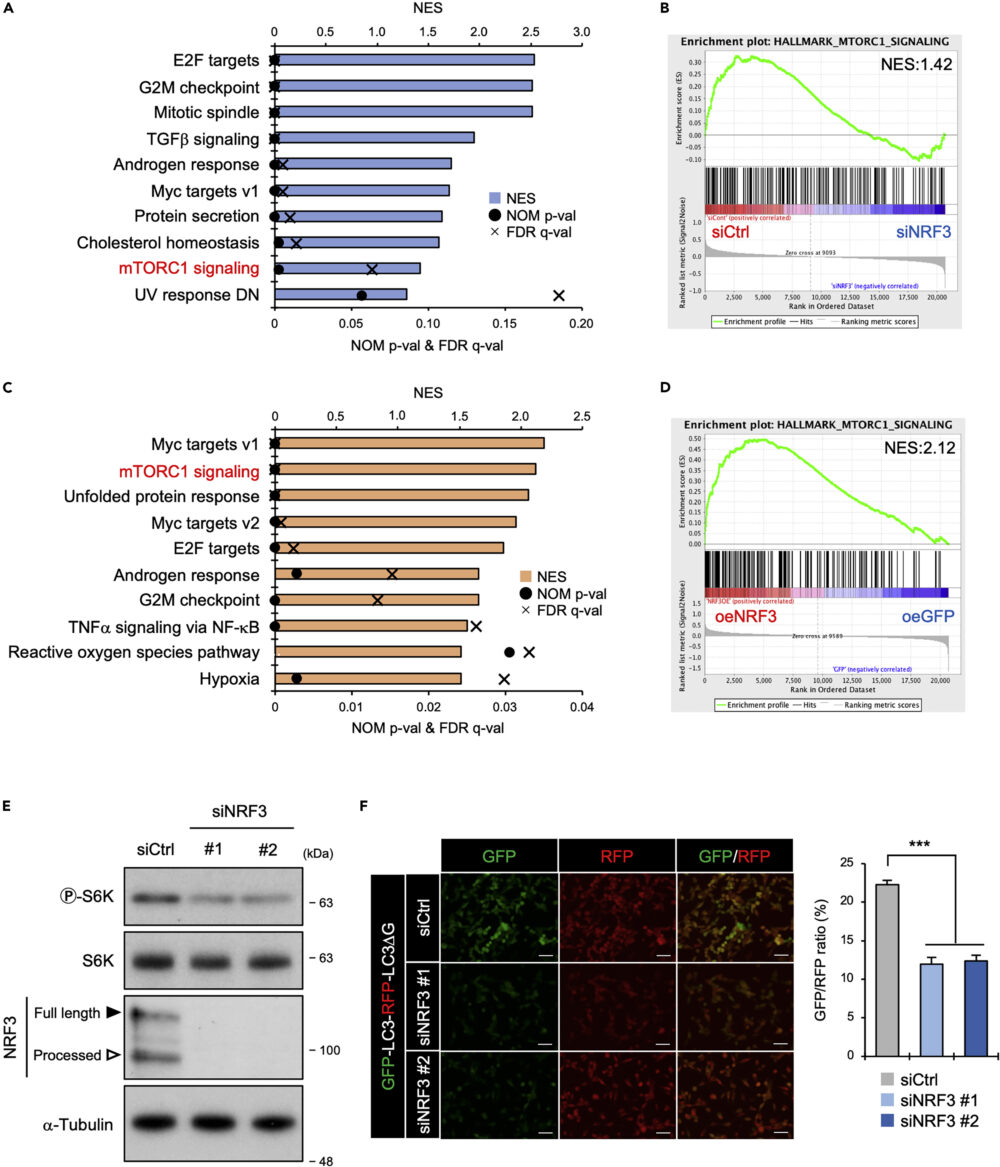
以前の研究(Waku T. (2021) iScience)で行ったDNAマイクロアレイ解析データを用いてGSEA(gene set enrichment analysis)を行ったところ、NRF3発現とmTORC1シグナル関連遺伝子群の発現に相関があることがわかりました(図1A-D)。
さらに、siRNAを用いてNRF3をノックダウンすると、mTORC1活性化の指標であるS6Kのリン酸化が減少しました(図1E)。つまり、NRF3ノックダウンでmTORC1の活性が落ちているということです。
では、mTORC1の下流に影響は出ているのでしょうか。
それを検証するため、プローブを用いてオートファジーの活性を定量しました。結果、NRF3ノックダウンで、mTORC1活性が落ちたことでオートファジーが活性化している、これまで知られていた知見と矛盾しないことがわかりました(図1F)。
以上の結果は、NRF3がmTORC1活性化に関与しているということを示しています。
2. NRF3はアミノ酸、特にアルギニンに応答してmTORをリソソームへリクルートする
NRF3はアミノ酸に応答し、mTORをリソソームへリクルートする
これまで、アミノ酸が欠乏した条件から回復した際に、mTORC1の活性化が引き起こされることがわかっていました。それではNRF3は、このアミノ酸量依存的なmTORC1活性化に必要な因子なのでしょうか。
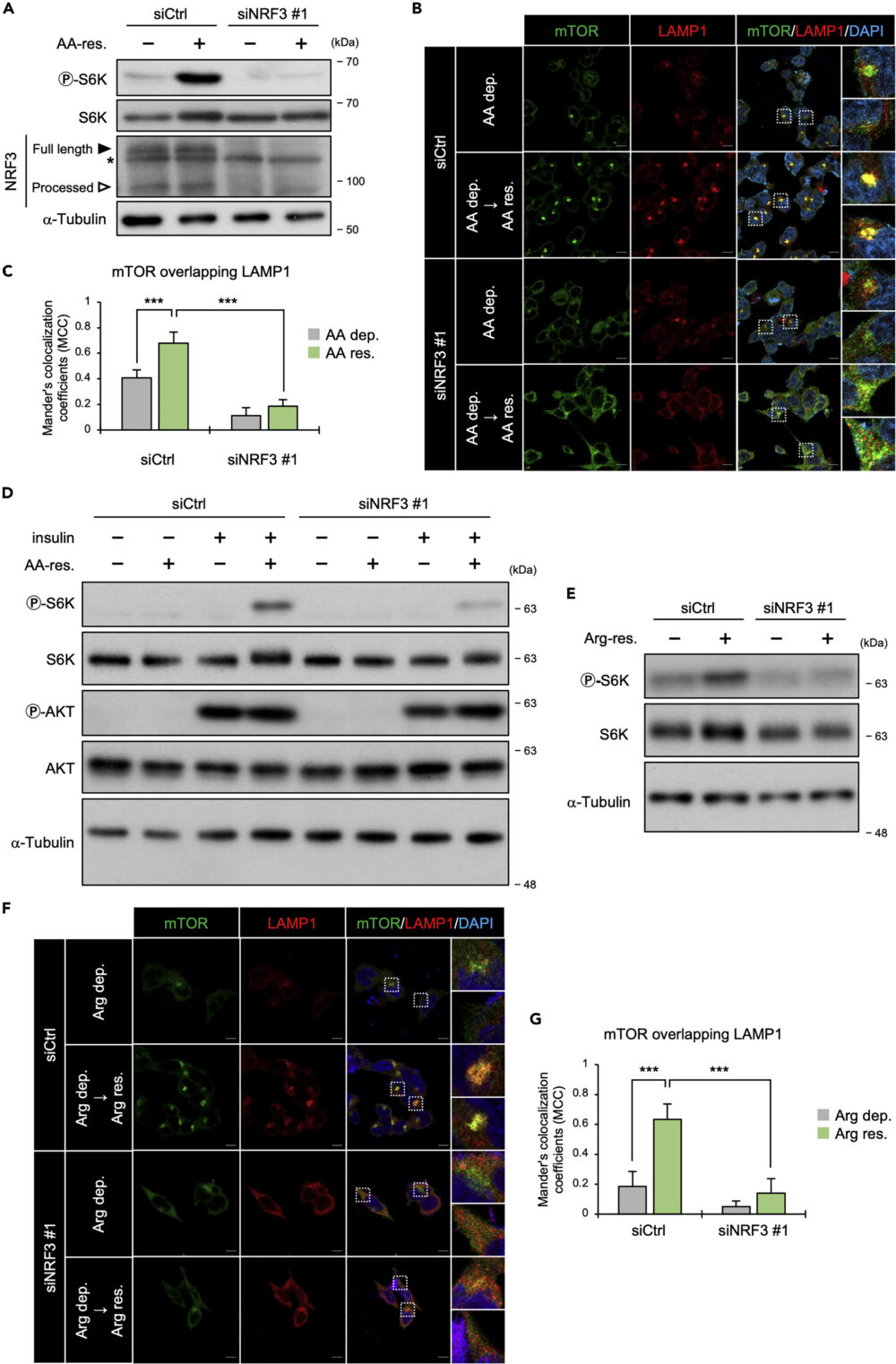
アミノ酸の回復で増加したmTORC1活性化の指標であるリン酸化S6Kは、NRF3をノックダウンした条件では増加しませんでした(図2A)。
これまでの研究(Sancak Y. (2008) Science, Efeyan A. (2012) Nature)から、細胞内のアミノ酸量の変化で、mTORC1のリソソーム表面への局在が制御されていることが報告されていました。では、NRF3はこのmTORC1の局在制御に関与しているのでしょうか。
そこで、mTORとリソソームマーカーであるLAMPの2種類を免疫染色し、細胞内での局在を確認しました。その結果、NRF3をノックダウンすると、mTORとLAMP1の共局在が見られなくなりました(図2B, C)。これらの結果から、NRF3はmTORのアミノ酸量に応じたリソソームへのリクルートに関わり、これはS6Kのリン酸化の結果(図2A)と一致するものです。
mTORC1はリソソーム表面にリクルートされると、インスリン-Rhebシグナル経路により活性化される。そこで、NRF3によるアミノ酸に応答したmTORC1活性化への、インスリンの影響を確かめました。
その結果、インスリンがないとアミノ酸によるmTORC1の活性化が見られないこと、そしてNRF3ノックダウンでこの活性化が著しく減少することを見出しました(図2D)。つまり、NRF3によるmTORC1のリソソームへのリクルートは、インスリンによるmTORC1活性化に影響しているということです。
アルギニンがNRF3によるmTORC1活性化に重要なアミノ酸である
それでは、どのアミノ酸がNRF3によるmTORC1活性化を誘導しているのでしょうか。これまでの研究(Hara K. (1998) JBC., Yao K. (2008) J. Nutr.)から、ロイシンとアルギニンがmTORC1活性化に関与していると報告されていました。
実験により、ロイシンはNRF3によるmTORC1活性化において、そこまで重要ではないということがわかりました。そこでこれ以降は、アルギニンに着目して研究を進めています。
アルギニン依存的なS6Kのリン酸化は、NRF3ノックダウンで減少することがわかりました(図2E)。さらに重要なことに、NRF3ノックダウンにより、アルギニンによるmTORとリソソームマーカーLAMP1との共局在が見られなくなりました(図2F, G)
これらの結果から、NRF3がアルギニンを利用してmTORC1をリソソームにリクルートしている可能性が見出されました。それでは、その詳細なメカニズムはどのようになっているのでしょうか。
3. NRF3はアルギニン欠乏で活性化し、SLC38A9とRagCの発現を誘導する
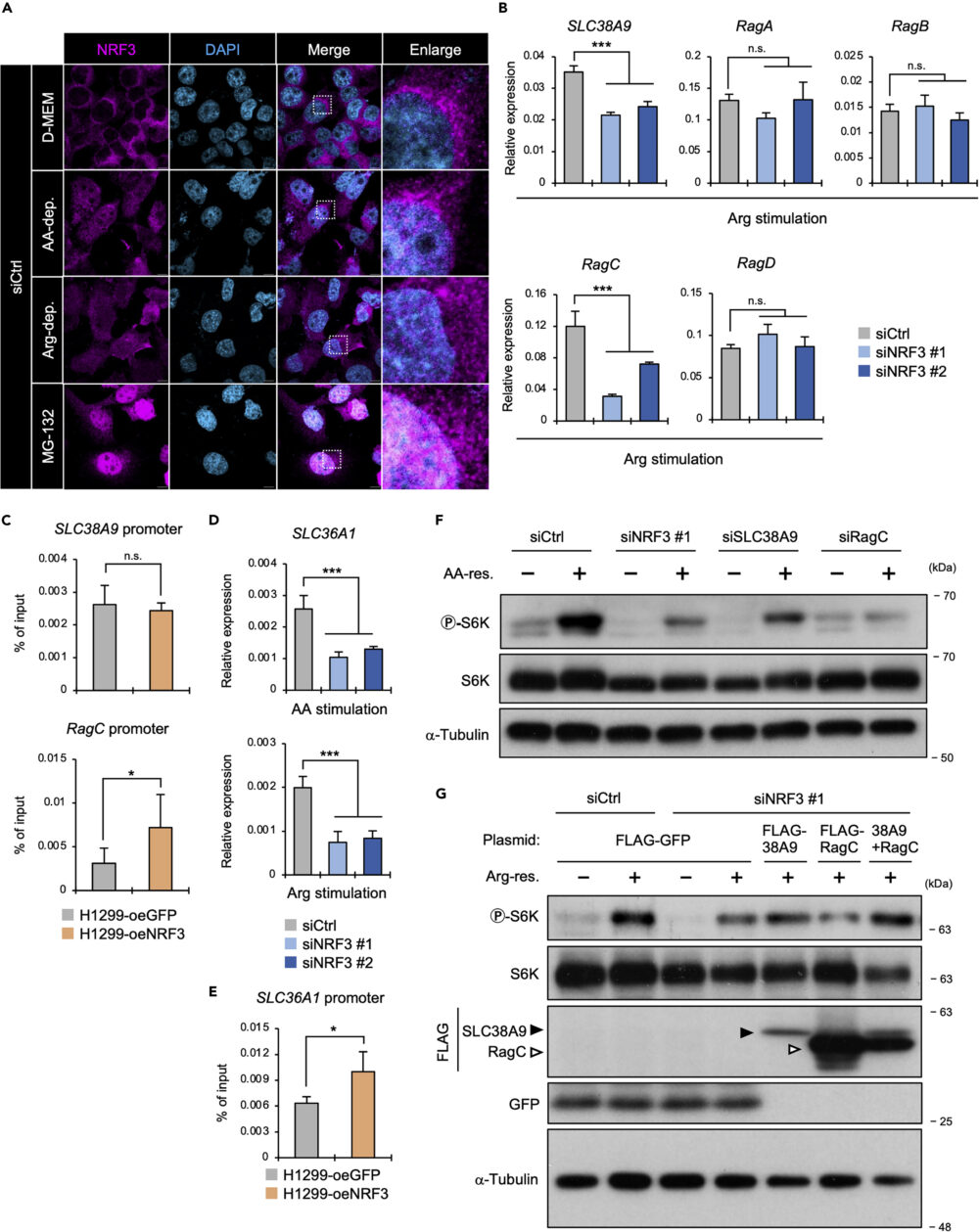
NRF3はアルギニン欠乏で活性化する
これまでの研究(Chowdhury AMMA. (2017) Sci. Rep.)から、
- NRF3は翻訳された直後に小胞体膜にアンカーされ、プロテアソームによって分解されている
- 細胞がストレスや刺激にさらされると、小胞体にアンカーされている部分が切断される
- 切断されたNRF3は核へ移行し、転写因子として遺伝子発現を活性化させる
ということがわかっています。しかしながら、細胞内でのNRF3量は少なく、さらに力価の高い抗体もないため、内因性のNRF3タンパク質の挙動を追うのは非常に難しいことです。そこでこの研究では、NRF3を安定的に過剰発現させた細胞株を用いて、アルギニンによるNRF3の変化を確かめました。
アミノ酸、もしくはアルギニンを欠乏させると、NRF3のタンパク質量が増加し、さらに核へ移行することが確認されました(図3A)。この結果は、アミノ酸、特にアルギニンの欠乏が、NRF3の活性化において重要な刺激であることを示唆するものです。
それでは、この核に移行したNRF3は、どのような遺伝子をターゲットとしているのでしょうか。この研究では、mTORC1活性化に必要な遺伝子のうち、リソソームでのアルギニンセンサーであるSLC38A9、mTORC1と結合して活性化させるRagA/RagB/RagC/RagDの5遺伝子に着目しました。
NRF3は、アルギニン刺激に応答してSLC38A9・RagCの発現を誘導することで、mTORC1を活性化する
リアルタイムPCRで遺伝子発現を定量した結果、アルギニンを欠乏した後回復させたとき、NRF3をノックダウンすることでSLC38A9とRagCの発現量が優位に低下することがわかりました(図3B)。また、クロマチン免疫沈降(ChIP)-qPCR解析の結果、NRF3はRagCのプロモーターには結合して直接制御するものの、SLC38A9のプロモーターには結合しないことがわかりました(図3C)。
それでは、SLC38A9はどのようにしてNRF3によって発現制御されているのでしょうか。以前の研究(Wang D. (2021) Biomolecules)では、SLC38A9タンパク質は、リソソーム表面でSLC36A1タンパク質と相互作用し、このトランスポーター複合体がお互いの発現を亢進させることが報告されています。そこで、SLC36A1の発現量およびプロモーター領域へのNRF3のリクルートを確認しました。
その結果、アミノ酸もしくはアルギニンを欠乏させた後で回復させた条件で、NRF3ノックダウンでSLC36A1の発現が低下し(図3D)、プロモーター領域にNRF3がリクルートされていることが確認されました(図3E)。
これらの結果から、SLC38A9はSLC36A1を介して間接的に、RagCは直接発現誘導してしていることが示唆されます。
さらに、NRF3のみならず、SLC38A9もしくはRagCのノックダウンでも、mTOCR1活性化の指標であるS6Kのリン酸化が減少しました(図3F)。これは、NRF3がアルギニンに応答し、これらの遺伝子発現を介してmTORC1を活性化させていることを示しています。
さらに確認するため、NRF3ノックダウンかつSLC38A9・RagCを過剰発現させました。その結果、NRF3ノックダウンで減少したリン酸化S6Kの量が、SLC38A9・RagCの過剰発現で回復することが、確認されました(図3G)。
以上の結果から、NRF3はSLC38A9およびRagCの発現を誘導することで、アルギニン依存的なmTORC1活性化を引き起こしていることがわかります。
4. NRF3は、RAB5によるマクロピノサイトーシス・SLC7A1による輸送により、アルギニンの取り込みを促進させる
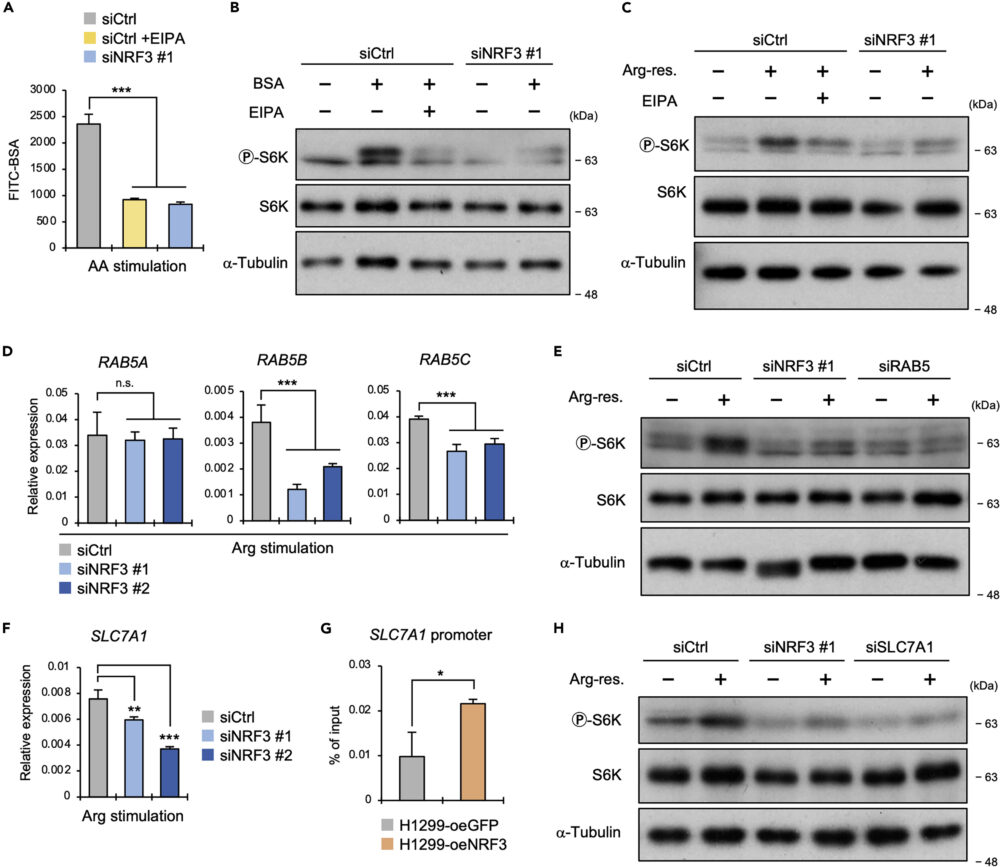
RAB5を介したマクロピノサイトーシスによるアルギニンの取り込み
マクロピノサイトーシスとは細胞外のタンパク質やアミノ酸を非特異的に取り込む現象のことで、mTORC1の活性化に重要です。以前の研究(Waku T. (2021) iScience)で、NRF3がマクロピノサイトーシスを誘導することで、細胞外のタンパク質と脂質の取り込みを促進していることが示されました。
そこで、アミノ酸欠乏した後で回復する条件下で、NRF3依存的にマクロピノサイトーシスが起こっているか、FITC標識したウシ血清アルブミン(FITC-BSA)を用いて確認しました。その結果、NRF3ノックダウンでFITC-BSAの蛍光強度が減少した(図4A)ことから、NRF3がmTORC1の活性化にマクロピノサイトーシスを利用しているという仮説が立ちます。
この仮説を検証するため、マクロピノサイトーシス阻害剤EIPA処理/NRF3ノックダウンかつ培地にBSAを添加することが、リン酸化S6Kへどのように影響するかを確認しました。コントロールではBSA添加でリン酸化S6Kが増加してEIPAによってそれがキャンセルされた一方で、NRF3ノックダウンではBSA添加によるリン酸化S6Kの増加は見られませんでした(図4B)。同じことが、アルギニン欠乏させた後で回復させた条件でも、確認されました(図4C)。
これらの結果は、マクロピノサイトーシス誘導が、NRF3によるアミノ酸、特にアルギニン依存的なmTORC1活性化に不可欠であることを示しています。
以前の研究(Waku T. (2021) iScience)で、NRF3がRAB5遺伝子(RAB5A、RAB5B、RAB5C)を制御することでマクロピノサイトーシスを誘導していることが示されています。この研究においても、アルギニン刺激条件下でNRF3ノックダウンによりRAB5遺伝子の発現が減少することを確認しました(図4D)。
また、RAB5ノックダウンにより、アルギニンによるリン酸化S6K量の増加がキャンセルされることが確認されました(図4E)。つまり、NRF3はRAB5を介してマクロピノサイトーシスを誘導し、アルギニンの取り込みとmTORC1の活性化を促進しているのです。
SLC7A1を介した輸送によるアルギニンの取り込み
NRF3は、アルギニン、リシン、オルニチンといった陽イオンアミノ酸のトランスポーターであるSLC7A1の遺伝子発現を誘導していることがわかりました(図4F)。さらにChIP-qPCRの結果から、SLC7A1のプロモーター領域にNRF3がリクルートされていることが、示されました(図4G)。
これらの結果から、NRF3によるアルギニン刺激による応答でのmTORC1の活性化において、SLC7A1が何かしら機能している可能性を見出すことができます。
この可能性を検証するため、SLC7A1をノックダウンしたところ、NRF3ノックダウンと同様にアルギニン刺激によるリン酸化S6K量の増加がキャンセルされることが確認されました(図4H)。つまり、NRF3はSLC7A1を介してアルギニンを取り込み、mTORC1の活性化を増強していることが示唆されます。
5. NRF3はワールブルグ効果、特にグルコース代謝経路に関与する
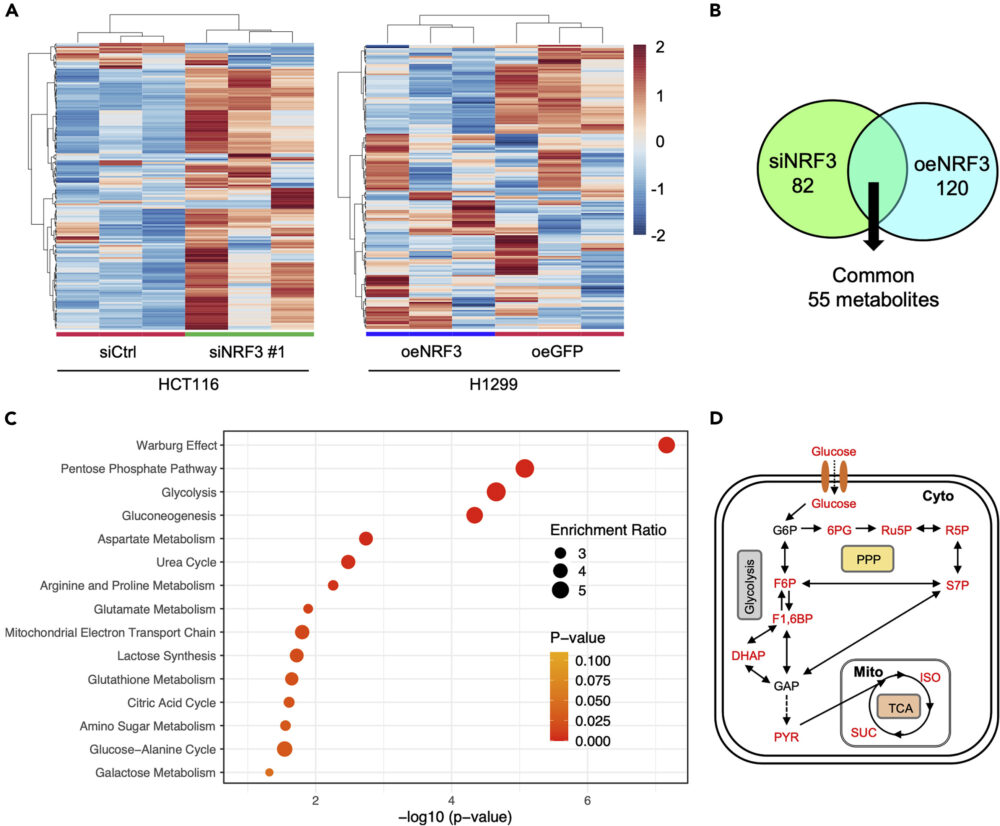
mTORC1の下流には、様々な代謝プロセスがあることが知られています。それでは、mTORC1の上流にあるNRF3は、どのような代謝制御にかかわるのでしょうか。それを確かめるため、NRF3ノックダウンとNRF3過剰発現の細胞で、メタボローム解析を行いました(図5A)。
この結果から、NRF3ノックダウンで82種の代謝物が、NRF3過剰発現で120種の代謝物が、これらに共通する代謝物は55種ありました(図5B)。さらにこれらの代謝物は、解糖系、ペントースリン酸経路、クエン酸回路をはじめとする、Warburg効果に関わるブドウ糖代謝経路に多く含まれていることがわかりました(図5C, D)。
この結果は、NRF3がグルコース代謝のリプログラミングに関与していることを示唆するものです。
6. NRF3-mTORC1経路を阻害すると、ミトコンドリアに異常をきたしてアポトーシスが引き起こされる
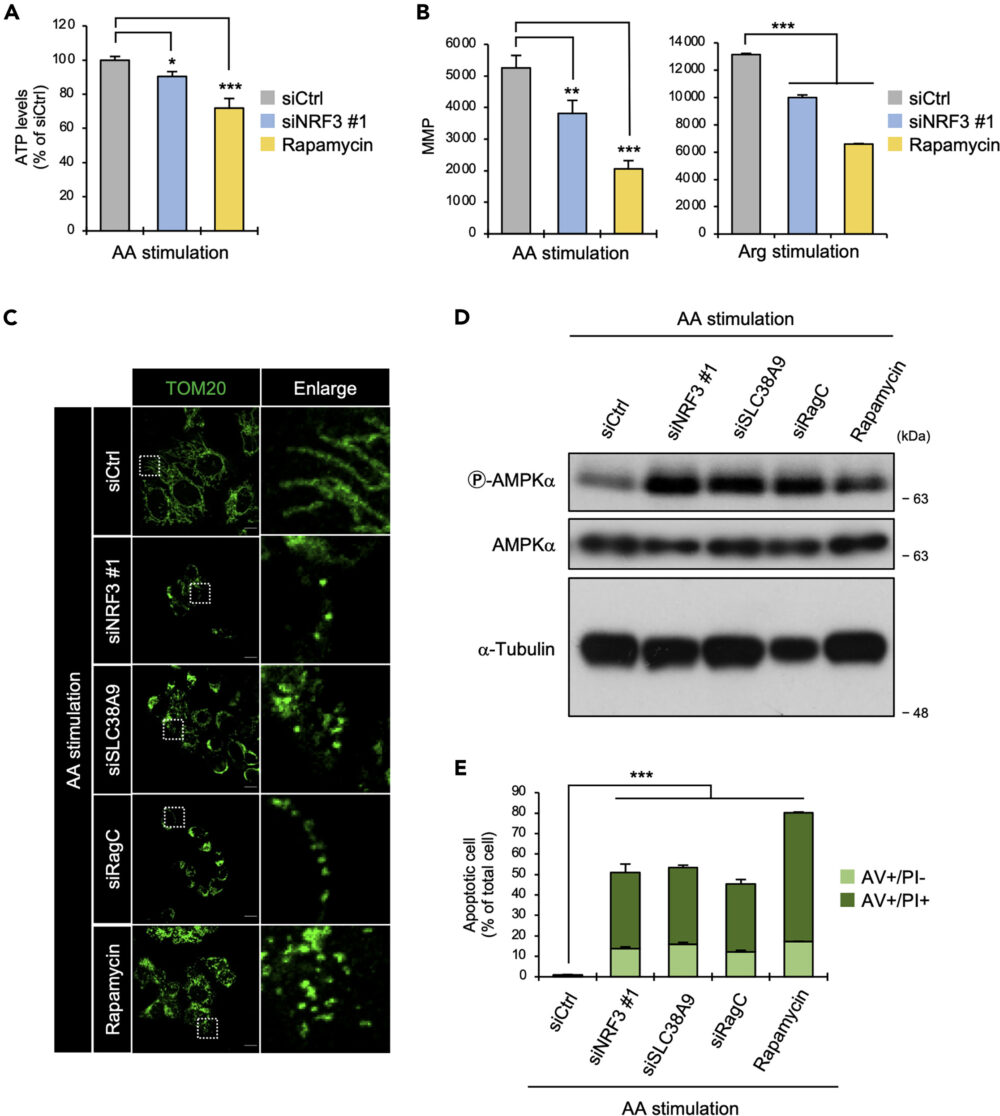
がん細胞において、Warburg効果はミトコンドリアでのATP産生に影響を与えます(Kappenol WH. (2011) Nat. Rev. Cancer)。そこで、アミノ酸刺激化でNRF3がATP産生に関与するかを検証するため、細胞内のATP量を測定しました。その結果、NRF3ノックダウンで細胞内のATP量が低下することがわかりました(図6A)。
つづいて、ATP産生に重要なミトコンドリア膜電位(Mitochondrial Membrane Potential; MMP)へのNRF3の影響を調べました。その結果、NRF3ノックダウンで、アミノ酸もしくはアルギニン刺激化でMMPの低下を確認しました(図6B)。また、ミトコンドリアの形態的にも、NRF3ノックダウンで損傷が生じていることがわかりました(図6C)。さらに興味深いことに、SLC38A9もしくはRagCのノックダウンでも、同様の結果が得られました(図6C)。
ミトコンドリアの損傷はアポトーシスにつながります。ミトコンドリアに損傷が見られたNRF3、SLC38A9、RagCのいずれをノックダウンした条件でも、アミノ酸刺激下でアポトーシスを起こしている細胞が増加していました(図6E)。
これらの結果からNRF3は、細胞を変動する細胞外のアミノ酸に適応させるため、ミトコンドリアの機能を維持していることが示唆されます。
7. NRF3-mTORC1経路が異常活性化すると、腫瘍が増大し予後が悪くなる
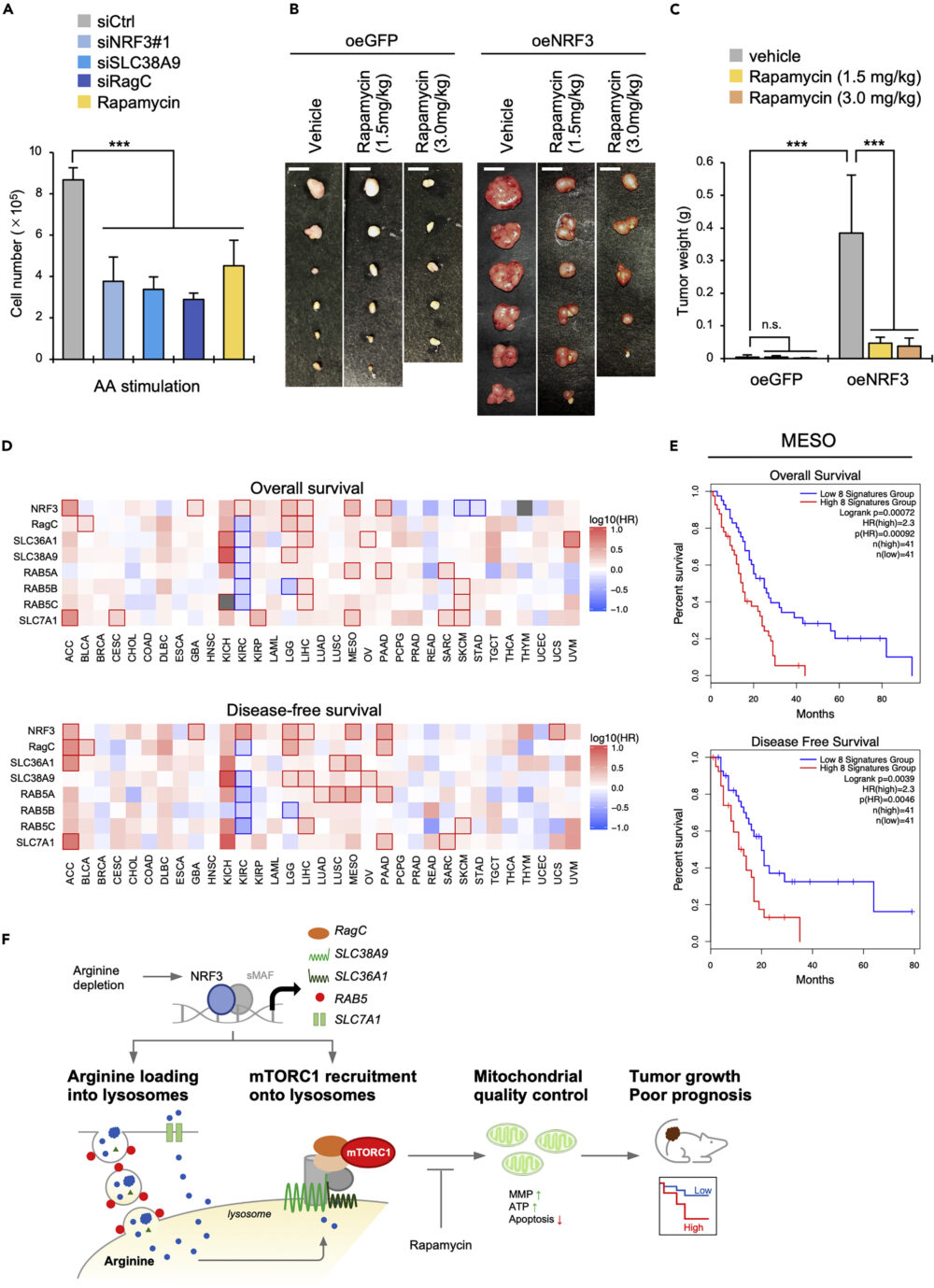
アポトーシス実験の結果(図6E)と一貫した結果として、アミノ酸刺激下でNRF3、SLC38A9、RagCをノックダウンすると、がん細胞の細胞数が減少することが確認されました(図7A)。
ここまでは培養細胞によるin vitroの実験でしたが、NRF3-mTORC1経路はin vivoでの腫瘍形成には関わっているのでしょうか。それを確認するため、NRF3過剰発現細胞を用いてxenograft実験を行いました。その結果、NRF3過剰発現で腫瘍が増大し、mTORC1阻害剤ラパマイシン投与でその増大が抑制されることが確認されました(図7B, C)。
最後に、この研究の中で着目した遺伝子の発現とがん患者の予後との関連を検証しました。33種のがんのうち、副腎皮質癌(adrenocortical carcinoma; ACC)、脳の低悪性度グリオーマ(lower-grade glioma; LGG)、肝細胞癌(liver hepatocellular carcinoma; LIHC)、中皮腫(mesothelioma; MESO)、膵臓腺癌(pancreatic adenocarcinoma; PAAD)の患者の全生存率または無病生存率は、NRF3遺伝子と、SLC36A1/SLC38A9/RagC/RAB5のアイソフォームのうち2つ以上の遺伝子の発現と、負の相関がありました(図7D)。
同様に、これらのがん患者のKaplan-Meierプロットから、NRF3、SLC36A1、SLC38A9、RagC、RAB5のアイソフォーム、SLC7A1の遺伝子発現が高い患者は、予後が悪いことがわかりました(図7E)。
これらの結果は、がんの進展において関連することがわかってきたNRF3-mTORC1経路が、病理学的にもがんの増悪に関わることを示しています。
まとめ
がん細胞は、栄養状況に応じて非常に速く増殖するため、mTORC1シグナルや代謝経路を調整します。CNCファミリー転写因子であるNRF3はがんの進展を促進することがわかっていましたが、がん細胞におけるNRF3とmTORC1の関係は未解明でした。本研究では、NRF3がアミノ酸、特にアルギニンに応答してmTORC1を活性化し、がん細胞を生存させていることが明らかになりました。NRF3は、アルギニン依存的なmTORC1のリソソームへのリクルートのために、SLC38A9やRagCの発現を促進します。また、RAB5によるマクロピノサイトーシスやSLC7A1による選択的輸送を介したアルギニンのリソソームへの輸送を、NRF3が促進させます。さらに、NRF3-mTORC1経路を抑制すると、ミトコンドリア機能が低下し、がん細胞のアポトーシスを誘導します。逆に、この経路が過剰に活性化すると、腫瘍が増殖し、予後が悪くなることが分かりました。この研究は、NRF3とアルギニン依存的なmTORC1活性化の関係について新たな知見をもたらし、がんの進展に関する病態生理学的な側面が明らかになりました。
この研究で使っている手法の解説記事